
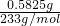 =0.0025mol,消耗碘单质的质量是:0.005mol×254g/mol=1.27g,故答案为:1.27g;
=0.0025mol,消耗碘单质的质量是:0.005mol×254g/mol=1.27g,故答案为:1.27g;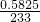 =0.0025mol,所以甲醛的物质的量为0.0025mol,在100mL溶液中,
=0.0025mol,所以甲醛的物质的量为0.0025mol,在100mL溶液中,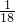 (1.540g-88g/mol-0.01mol-1×0.01mol)=0.02mol,所以x:y:z=1:1:2,次硫酸氢钠甲醛的组成为:NaHSO2?HCHO?2H2O.
(1.540g-88g/mol-0.01mol-1×0.01mol)=0.02mol,所以x:y:z=1:1:2,次硫酸氢钠甲醛的组成为:NaHSO2?HCHO?2H2O.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:单选题
 CaSiO3+CO2↑
CaSiO3+CO2↑ Si+2CO↑
Si+2CO↑查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
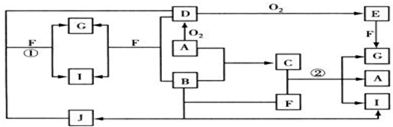
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| AgNO3溶液 | 加有酚酞的NaOH溶液 | 石蕊溶液 | 品红溶液 | Na2CO3溶液 | |
| A | 产生沉淀 | 无明显变化 | 变红 | 溶液褪色 | 有气泡 |
| B | 无明显变化 | 溶液褪色 | 变红 | 无明显变化 | 产生沉淀 |
| C | 产生沉淀 | 溶液褪色 | 先变红后褪色 | 溶液褪色 | 有气泡 |
| D | 产生沉淀 | 无明显变化 | 先变红后褪色 | 无明显变化 | 产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
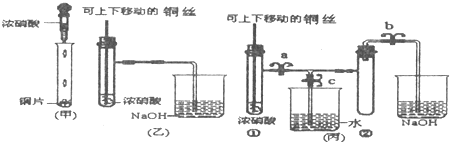
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com