
 LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.
LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.分析 (1)用稍过量的稀H2SO4溶解废铁屑,滤液中主要溶质为FeCl2,向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,向含Fe3+的溶液加入Na2HPO4溶液,过滤后经进一步处理得FePO4.
①稀H2SO4溶解废铁屑时,有氢气产生;
②向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,过氧化氢被还原为水;
③向含Fe3+的溶液加入Na2HPO4溶液,Fe3+消耗PO43-,使平衡HPO42-?PO43-+H+右移,氢离子浓度增大,使平衡H2PO4-?HPO42-+H+左移,则溶液中H2PO4-浓度增大;
④Na2HPO4溶液显碱性的原因是水解程度大于电离程度;
(2)铁元素的化合价从+3价降到+2价,得到电子,说明化合物LiI中碘离子失去电子作还原剂;
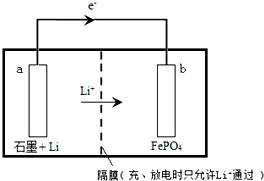
(3)①金属Li可与水发生反应(或2Li+2H2O=2LiOH+H2↑),故应为非水材料,
②根据锂离子电池的电池反应式为:FePO4(s)+Li(s)$?_{充电}^{放电}$LiFePO4(s),可知,放电时,Li的化合价升高,被氧化,a为原电池的负极,充电时,反应逆向进行,b为阳极,阳极上失电子发生氧化反应,电极反应式为LiFePO4-e-═Li++FePO4.
解答 解:(1)用稍过量的稀H2SO4溶解废铁屑,滤液中主要溶质为FeCl2,向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,向含Fe3+的溶液加入Na2HPO4溶液,过滤后经进一步处理得FePO4.
①稀H2SO4溶解废铁屑时,有氢气产生,当反应完全时,则不再产生气泡,
故答案为:不再产生气泡;
②向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,过氧化氢被还原为水,离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
③向含Fe3+的溶液加入Na2HPO4溶液,Fe3+消耗PO43-,使平衡HPO42-?PO43-+H+右移,氢离子浓度增大,使平衡H2PO4-?HPO42-+H+左移,则溶液中H2PO4-浓度增大,产生FePO4的离子方程式是:Fe3++2HPO42-=FePO4↓+H2PO4,
故答案为:Fe3++2HPO42-=FePO4↓+H2PO4;
④Na2HPO4溶液显碱性的原因是由于HPO42-可以电离:HPO42-?PO43-+H+,又可以水解:HPO42-+H2O?H2PO4-+OH-,且水解程度大于电离程度,所以溶液溶解显碱性,
故答案为:由于HPO42-可以电离:HPO42-?PO43-+H+,又可以水解:HPO42-+H2O?H2PO4-+OH-,且水解程度大于电离程度,所以溶液溶解显碱性;
(2)将FePO4与LiI混合,在惰性气氛中加热,制得LiFePO4,铁元素的化合价从+3价降到+2价,得到电子,说明化合物LiI中碘离子失去电子作还原剂,
故答案为:还原剂;
(3)①金属Li可与水发生反应(或2Li+2H2O=2LiOH+H2↑),故应为非水材料,
故答案为:金属Li可与水发生反应(或2Li+2H2O=2LiOH+H2↑);
②根据锂离子电池的电池反应式为:FePO4(s)+Li(s)$?_{充电}^{放电}$LiFePO4(s),可知,放电时,Li的化合价升高,被氧化,a为原电池的负极,负极的电极反应式:Li-e-=Li+;充电时,反应逆向进行,b为阳极,阳极上失电子发生氧化反应,电极反应式为LiFePO4-e-═Li++FePO4,
故答案为:LiFePO4-e-=Li++FePO4.
点评 本题考查物质制备,原电池、电解池原理的分析判断,主要是过程分析判断,化学方程式和离子方程式的书写应用,从化合价变化的角度分析,注意把握Li的化学性质,掌握物质性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
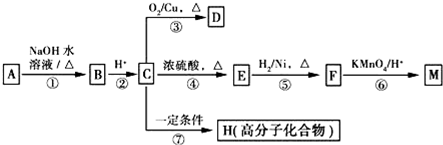
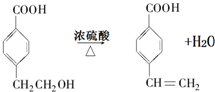
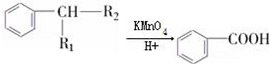 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子) .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
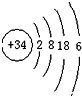 推测硒在元素周期表中第四周期;
推测硒在元素周期表中第四周期;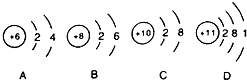
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
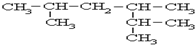
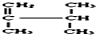 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯;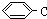 ≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个.
≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个. 表示的分子式C6H14.
表示的分子式C6H14.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业采用火法炼铜:Cu2S+O2=2Cu+SO2 每生成2mol铜,反应共转移4NA个电子 | |
| B. | 7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.1NA | |
| C. | CO2通过Na2O2使其增重bg时,反应中转移的电子数为$\frac{b{N}_{A}}{44}$ | |
| D. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③混合,若溶液pH=7,则体积V(NaOH)>V(CH3COOH) | |
| D. | 将②与④等体积混合,各离子浓度的关系为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
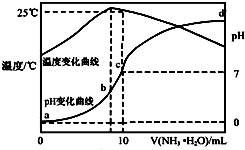 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a点Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 25℃时NH4Cl水解常数为(n-1)×10-7 mol•L-1(用n表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64gSO2含有硫原子数为2NA | |
| B. | NA个氧分子和NA个氢分子的质量比等于16:1 | |
| C. | 28g氮气所含的原子数目为NA | |
| D. | 标准状况下,22.4L的水含有 NA个水分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com