

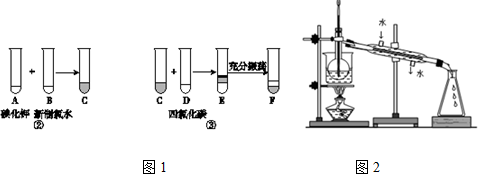
分析 海带灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,浸泡过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用四氯化碳萃取得到含碘的有机溶液,经蒸馏可得到碘,
(1)分离固体和溶液通常采用过滤操作,分离互溶液体通常采用蒸馏的方法;
(2)F中利用碘单质在四氯化碳中溶解度大,四氯化碳比水重,上层为氯化钾;
(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏;
(4)物质的灼烧用到的核心仪器是坩埚;
(5)①CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液;
②(G)步骤可使液体顺利流下;
解答 解:(1)根据流程可知,分离不溶物与溶液的方法为过滤,所以从悬浊液中分离出溶液的操作为过滤;因为碘在有机溶剂中的溶解度比水大,且碘和有机溶剂易于分离,所以用萃取分液;
故答案为:过滤;萃取分液;
(2)四氯化碳不溶于水,比水重,碘单质在四氯化碳中溶解度大于水中,四氯化碳层为紫红色,上层为主要溶质是氯化钾;
故答案为:下层为紫红色;
(3)从碘的四氯化碳溶液中得到单质碘,利用碘单质和四氯化碳沸点不同用蒸馏方法分离,实验装置如图所示,该实验采用的加热方式为水浴加热,便于控制温度加热均匀,
故答案为:蒸馏;水浴加热;
(4)物质的灼烧用到仪器有:坩埚、酒精灯、三脚架、泥三角、烧杯、玻璃棒,故选BCE,
故答案为:BCE;
(5)①CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,则步骤为C→B→D→A→H→G→E→F,
故答案为:C;B;D;H;
(2)(G)步骤将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔的目的为:保持内外压强相通操作时漏斗里液体能够流出,
故答案为:操作时漏斗里液体能够流出.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质选择分离、提纯的方法为解答的关键,侧重分离原理及分离实验步骤的考查,题目难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 制备无水AlCl3时,加入的SOCl2只起脱水剂作用 | |
| B. | 电池工作过程中,SOCl2被还原为Li2SO3和S单质 | |
| C. | 电池工作过程中,电子经电解质溶液流向锂电极 | |
| D. | 用该电池电解水,生成2mol H2,消耗1.5molSOCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
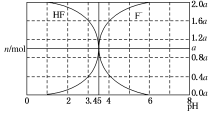 25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )
25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )| A. | pH=3 时,溶液中:c(Na+)>c(F-) | |
| B. | c(F-)>c(HF)时,溶液一定呈碱性 | |
| C. | pH=4 时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2a mol?L-1 | |
| D. | pH=3.45 时,NaOH 溶液恰好与 HF 完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 性质 | 用途 | |
| A | HF溶液具有酸性 | 能用HF溶液在玻璃上刻图案 |
| B | SO2具有强还原性 | SO2常用于漂白秸秆、织物 |
| C | CuSO4具有氧化性 | CuSO4和熟石灰配波尔多液 |
| D | CH3CH2OH燃烧放出大量热量 | 酒精常作清洁能源 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
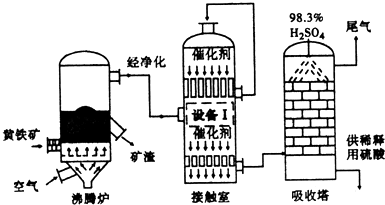
| 截面位置 含量 过程气体流 | 1(接触室人口处) | 2 | 3 | 4 |
| O2物质的量的百分含量 | 11.0% | 10.10% | 8.48% | 8.48% |
| SO2物质的量的百分含量 | 6.00% | 4.04% | 0.51% | 0.51% |
| SO3物质的量的百分含量 | 1.00% | 3.03% | 6.68% | 6.68% |
| N2物质的量的百分含量 | 81.00% | 81.83% | 83.31% | 83.31% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(Cl-)>c(OH- )>c( H+ ) | B. | c(Cl-)>c(NH4+)>c( H+ )>c(OH-) | ||
| C. | c(NH4+)+c( H+ )=c(Cl-)+c(OH- ) | D. | c(NH4+)+c( NH3•H2O )=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| C. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2═NO3-+NO↑+H2O | |
| D. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com