
下列检验的方法一定可以达到目的的是
A.向溶液中滴入盐酸酸化的氯化钡溶液可检验溶液中是否含SO42+
B.向溶液中滴入盐酸酸化后,再滴入硝酸银溶液可检验溶液中是否含有Cl-
C.向白色固体中滴入稀盐酸可检验白色固体是否是碳酸盐
D.用浓盐酸检查氨气管道是否泄漏
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
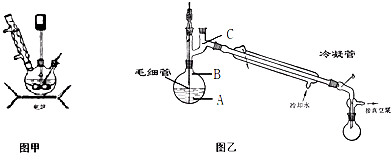
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
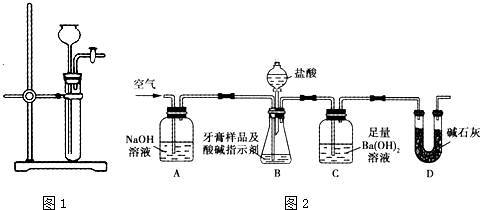
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(22分)Ⅰ.盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,同答下列问题:(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入![]() 后,则可使铜溶解。该反应的离子方程式为_______________________________。
后,则可使铜溶解。该反应的离子方程式为_______________________________。
某同学未加入氧化剂,而是将它设计成一个电解装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:
|
(2)在一定体积的18 mol?L![]() 的浓硫酸中加入过量的铜片,加热使之反直,被还原的硫酸是0.9mol,则该硫酸的实际体积_______(填“大于”、“等于”或“小于”)100mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?_______________(填“可行”或“不可行”)。
的浓硫酸中加入过量的铜片,加热使之反直,被还原的硫酸是0.9mol,则该硫酸的实际体积_______(填“大于”、“等于”或“小于”)100mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?_______________(填“可行”或“不可行”)。
Ⅱ.某化学小组欲探究铁及其忱合物的氧化性和还原性,请回答下列问题:
试剂:铁粉、![]() 溶液、
溶液、![]() ,溶液、氯水、锌片、铜片、
,溶液、氯水、锌片、铜片、![]() 溶液。
溶液。
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是________________。
(2)实验记录(划斜线部分不必填写):
序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
① | 在 | 溶液由浅绿色变为棕黄色 |
|
|
② | 在 |
|
|
|
③ | 在 |
|
|
|
④ |
|
|
|
|
实验结论:![]() 只有还原性,
只有还原性,![]() 只有氧化性,
只有氧化性,![]() 既有氧化性,又有还原性。
既有氧化性,又有还原性。
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化_____________________________________________________,
并简述![]() 的检验的方法_________________________________________________________
的检验的方法_________________________________________________________
_____________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com