
【题目】能源是人类生存和发展的重要支柱。研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义。已知H2与CO反应生成CH3OH的过程如图所示:
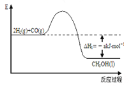
CO的燃烧热△H2=-bkJ·mol-1,CH3OH的燃烧热
△H3=-ckJ·mol-1。请根据以上信息,回答下列有关问题:
(1)甲醇是一种(填“可”或“不可”)再生能源,甲醇的官能团的电子式是 。
(2)CH3OH燃烧的热化学反应方程式为。
(3)H2的燃烧热△H=。
(4)一些化学键键能如下:C≡O为dkJ/mol;O=O为ekJ/mol;C=O为fkJ/mol。则由以上数据有b=
(用d、e、f的代数式表示)。
(5)H2和CO的混合气体nmol,充分燃烧共放出QkJ热量,则混合气体中H2和CO的物质的量之比为。
(6)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的正极反应式。
【答案】(1)可![]() (2)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-2ckJmol-1
(2)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-2ckJmol-1
(3)_0.5(a+c-b)kJmol—1
(4)2f-d-0.5e
(5)(2bn-2Q):(bn-an-cn+2Q)
(6)O2+4e—+2H2O=4OH—
【解析】
试题分析:(1)甲醇是可再生能源,所含官能团为![]() ;
;
(2)CH3OH的燃烧热△H3=-ckJmol-1;燃烧热是可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式为:2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-2ckJmol-1;
(3)依据甲醇和一氧化碳的燃烧热计算氢气的燃烧热:
①2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-2ckJmol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-2bkJmol-1;
③2H2(g)+CO(g)=CH3OH(l)△H=-aKJ/mol;
依据盖斯定律,③×2-②+①得到:4H2(g)+2O2(g)=4H2O(l)△H=-(2a-2b+2c)KJ/mol;
依据氢气的燃烧热是1mol氢气完全燃烧生成液态水放出的热量,氢气的燃烧热=![]() KJ/mol;
KJ/mol;
(4)一些化学键键能如下:C≡O为dkJ/mol;O=O为ekJ/mol;C=O为fkJ/mol.
反应为:2CO(g)+O2(g)=2CO2(g)△H=-2bkJmol-1;
反应的焓变=反应物的键能之和-生成物的键能之和=2d+e-2×f×2=△H=-2b
b=2f-d-e/2;
(5)H2和CO的混合气体nmol,设氢气为物质的量为X,一氧化碳物质的量为n-X;充分燃烧共放出QkJ热量
2CO(g)+O2(g)=2CO2(g)△H=-2bkJmol-1;
22b
n-Xb(n-X)
2H2(g)+O2(g)=2H2O(l)△H=-(a-b+c)KJ/mol
2a+c-b
Xx/2(a+c-b)
得到:b(n-X)+x/2(a+c-b)=Q;
计算得到:X=![]() ;
;
混合气体中H2和CO的物质的量之比=![]() =(2bn-2Q):(bn-an-cn+2Q);
=(2bn-2Q):(bn-an-cn+2Q);
(6)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,发生的电池反应的离子方程式为:2CO+O2+4OH-=2CO32-+2H2O;原电池的正极电极反应为:O2+2H2O+4e-=4OH-;用总反应离子方程式减去正极电极反应,化简得到负极电极反应:CO-2e-+4OH-=CO32-+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.化学反应的焓变与反应的途径有关
B.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力减弱
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.等质量的铜按a、b两种途径完全转化为Cu(NO3)2,途径a、b消耗的硝酸一样多
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法中,正确的是( )
A. 钠在空气中燃烧只生成白色的氧化钠固体
B. 燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧
C. 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作
D. 铁能与硫酸发生反应,故不能用铁制容器贮存浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学中常见的物质,它们之间的转化关系加下图所示(部分产物已略去)。请回答下列问题:
![]()
(1)若A能使湿润的红色石蕊试纸变蓝,C为红棕色的气体。A转化为B的化学方程为 ,
请写出实验室制取A的化学方程式: 。
(2)若B是一种常见的温室气体,则B转化为C的化学方程式 。
(3)若X是金属单质,向B、C溶液中分别滴加AgNO3溶液,均产生不溶于稀硝酸的白色沉淀,则B的化学式为 。保存C溶液常加入少量X,其目的是 ,请写出B转化为C的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于葡萄糖的说法中,错误的是( )
A.葡萄糖的分子式是C6H12O6
B.葡萄糖是多羟基醛,因而具有醛和多元醇的性质
C.葡萄糖是最简单的醛糖
D.葡萄糖可以通过绿色植物光合作用合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有盐酸、NaCl溶液、NaOH溶液和新制氯水,可用来区别它们的试剂是
A.酚酞试液 B.紫色石蕊试液
C.AgNO3 溶液 D.NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜,当两装置电路中通过的电子都是1mol时,下列说法不正确的是
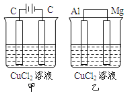
A.溶液的导电能力变化:甲>乙
B.溶液的质量减小程度:甲>乙
C.甲中阴极和乙中镁电极上析出物质质量:甲=乙
D.电极反应式:甲中阳极:2Cl--2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
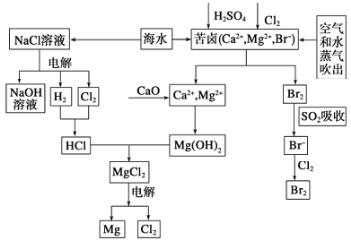
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ___________________。
(2)①电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com