
【题目】按要求作答。
(1)①写出MgO的名称________________;②写出乙炔的结构式______。
(2)写出NaHCO3受热分解的化学方程式______________。
(3)写出Cl2与NaOH溶液反应的离子方程式_____________。
(4)海带中提取碘的过程中,将I-氧化生成I2时,若加入过量的氯水,则Cl2将I2氧化生成HIO3,同时还有一种强酸生成,写出该反应的化学方程____________。
【答案】氧化镁 H-C≡C-H 2NaHCO3![]() Na2CO3+CO2↑+H2O Cl2+2OH-=Cl-+ClO-+H2O 5Cl2+I2+6H2O = 2HIO3+10HCl
Na2CO3+CO2↑+H2O Cl2+2OH-=Cl-+ClO-+H2O 5Cl2+I2+6H2O = 2HIO3+10HCl
【解析】
(1)①MgO的名称是氧化镁;②乙炔的分子式是C2H2,结构式H-C≡C-H;
(2) NaHCO3受热分解为碳酸钠、二氧化碳、水,反应的化学方程式2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(3) Cl2与NaOH溶液反应生成氯化钠、次氯酸钠、水,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;
(4) Cl2将I2氧化生成HIO3,根据氧化还原反应规律,同时还有盐酸生成,根据得失电子守恒配平反应的化学方程为5Cl2+I2+6H2O = 2HIO3+10HCl。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。

(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是
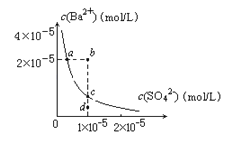
A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:

①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。利用下图所示装置(图中夹持仪器略去)进行牙膏样品中碳酸钙的定量测定实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:____
(2)C中反应生成BaCO3的化学方程式是__________________。
(3)下列各项措施中,不能提高测定准确度的是_________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是_____
(6)上述实验中用到的氢氧化钠以食盐为原料进行生产的。食盐在生产生活中应用广泛,下图是以食盐为原料并综合利用的某些过程如下图所示。

I.除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) __________。
a.Na2CO3 b.NaOH c.BaCl2
II.电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ____________,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是__________。
III.气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是________。
IV.下列有关NaHCO3和纯碱的说法正确的是__________(填字母)
A.NaHCO3属于盐类,纯碱属于碱
B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同
C.常温下在水中的溶解度,NaHCO3大于纯碱
D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
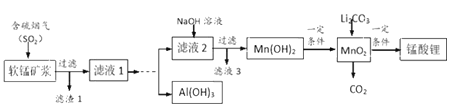
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)为提高含硫烟气中SO2的吸收率,可以采取的措施_____________(举一例)。
(2)滤液1中所含金属阳离子有Mn2+、_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式___________;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)电源A极的名称是____,丁中____(填“X”或“Y”)极颜色会加深。
(2)欲用丙装置给铜镀银,H应该是____,电镀液的主要成分是____(填化学式)。
(3)如果收集乙装置中产生的气体,相同条件下两种气体的体积比是___。
(4)甲装置为使用过的铅蓄电池,充电后电极D应与用电器的____(填“正”或“负”)极连接,电极C上的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:
![]()
则下列说法正确的是( )
A.![]() 的分子式为C4H4O
的分子式为C4H4O
B.①、②、③的反应类型分别为卤代、水解、消去
C.A能使高锰酸钾酸性溶液褪色
D.A的结构简式是CH2=CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如图1:
(已知:NaCl熔点为801℃;AlCl3在181℃升华;固体直接变为气体叫做升华)

(1)把NaCl和AlCl3的固体混合物置于如图2所示的装置的一端,加热到___(最低温度)℃,即可分离NaCl和AlCl3
(2)将Cl2连续通入坩埚中的粗铝熔体里,杂质随气泡上浮除去气泡的主要成分除Cl2外还含有___;固态杂质黏附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在的物质是___。
(3)用废碱液处理气体A的过程中,所发生反应的离子方程式有:①H++OH-=H2O,②___
(4)镀铝电镀池中,金属铝为阳极,熔融盐电镀池中存在Na+K+______等离子钢材表面(电极)的电极反应式为AlCl4-+3e-=Al+4Cl-或___
(5)钢材镀铝后,在表面氧化成致密的___,避免钢材接触空气而防止钢材被腐蚀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com