

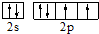
 ,故答案为:
,故答案为: ;氧;
;氧;| 5-1×3 |
| 2 |
| 1 |
| 8 |
| 2M |
| NA |
4
| ||
| 3 |
4
| ||
| 3 |
4
| ||
| 3 |
| 2M |
| NA |
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
| ① |
|
|
|
|
|
|
|
| |||||||||
|
|
|
| ④ | ⑤ | ⑥ |
|
| ||||||||||
| ② |
|
|
|
|
|
| ⑦ |
| |||||||||
|
|
|
|
|
|
|
| Fe |
|
|
|
|
|
| As |
|
|
|
I.元素周期表是人们研究物质性质的重要工具
Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为 ,当消耗1mol还原剂时,电子转移了 ________mol。
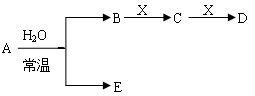
Ⅱ.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为氧化物,则A的化学式为 ,A与水反应的化学方程式为 ,该反应中氧化剂和还原剂的物质的量之比为 。
① 当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为 ,表示X呈碱性的离子方程式为 。
② 当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
(2)若E为单质气体,D为白色沉淀,A的化学式可能是 ,B含有的化学键类为 ,C与X反应的离子方程式为 。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,则该可逆反应的化学方程式为 。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达平衡,该温度下反应的平衡常数K=1,D的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年度北京五中高三第一学期期中考试化学试卷 题型:填空题
下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
| ① | | | | | | | | | |||||||||
| | | | ④ | ⑤ | ⑥ | | | ||||||||||
| ② | | | | | | | ⑦ | | |||||||||
| | | | | | | | Fe | | | | | | | As | | | |
查看答案和解析>>
科目:高中化学 来源:2015届吉林省长春外国语学校高一下学期期中考试化学试卷(解析版) 题型:填空题
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。请回答:
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
⑤ |
|
⑥ |
|
|
|
3 |
① |
③ |
④ |
|
|
|
⑦ |
⑨ |
|
4 |
② |
|
|
|
|
|
⑧ |
|
(1)这九种元素中(填元素符号)⑤是 ,其中化学性质最不活泼的是 。
⑤和⑥形成化合物的电子式
(2)在这些元素的最高价氧化物对应的水化物中,碱性最强的是(填化学式)。
酸性最强的是 呈两性的是 ,写出三者之间相互反应的化学方程式 ;
(3)①、②、③三种元素按原子半径由大到小的顺序依次为 (填元素符号)。
(4) 用电子式表示⑧元素与③元素形成化合物的过程 。
(5) 在①和②中化学性质最活泼的是
(6)在⑦和⑧中化学性质最活泼的是 ,用化学实验证明的方法和离子方程式:
方法
离子方程式
查看答案和解析>>
科目:高中化学 来源:2012届度北京五中高三第一学期期中考试化学试卷 题型:填空题
下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
|
① |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
④ |
⑤ |
⑥ |
|
|
||||||||||
|
② |
|
|
|
|
|
|
⑦ |
|
|||||||||
|
|
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
As |
|
|
|
I.元素周期表是人们研究物质性质的重要工具
Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为 ,当消耗1mol还原剂时,电子转移了 ________mol。
Ⅱ.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
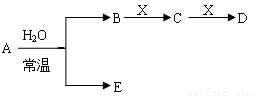
(1)若E为氧化物,则A的化学式为 ,A与水反应的化学方程式为 ,该反应中氧化剂和还原剂的物质的量之比为 。
① 当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为 ,表示X呈碱性的离子方程式为 。
② 当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
(2)若E为单质气体,D为白色沉淀,A的化学式可能是 ,B含有的化学键类为 ,C与X反应的离子方程式为 。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,则该可逆反应的化学方程式为 。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达平衡,该温度下反应的平衡常数K=1,D的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com