

| 实验步骤 | 预期现象 |
| 步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 | |
| 步骤二:检验Fe3+,往试管Ⅰ中,滴入几滴KSCN溶液 | 溶液呈现血红色 |
| 步骤三:检验Fe2+,往试管Ⅱ中,滴入少量KMnO4溶液(或先滴入几滴稀硫酸) | 紫红色变浅或消褪 |
分析 (1)用“可抽动的铁丝”代替“直接投入铁片”可随时控制反应的进行和停止;
(2)二氧化硫能使品红褪色,具有毒性,能被氢氧化钠吸收;
(3)①铁与浓硫酸反应,铁可能被氧化成Fe3+或Fe2+;
②设计实验方案验证假设3:须验证Fe3+和Fe2+,Fe3+能氧化碘离子,Fe2+能还原高锰酸根离子;
(4)反应C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O中,浓硫酸表现强氧化性;若要验证反应产物中同时混有SO2气体和CO2气体,先检验二氧化硫,再除净二氧化硫,最后检验二氧化碳即可.
解答 解:(1)在加热的条件下,当铁丝与浓硫酸接触时才能反应,当往上抽动铁丝时,铁丝与硫酸不接触,反应停止,所以用“可抽动的铁丝”的优点是便于控制反应的反应,故答案为:可随时控制反应的进行和停止;
(2)SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,所以能说明有SO2气体产生的实验现象是品红溶液褪色,二氧化硫具有毒性,能被氢氧化钠吸收,故答案为:品红溶液褪色;吸收多余的SO2气体,防止尾气污染(环境);
(3)①铁与浓硫酸反应,铁可能被氧化成Fe3+或Fe2+;对A中溶液的金属离子,可能有:只含有Fe3+;只含有Fe2+;
既有Fe2+,又有Fe3+,三种情况,故答案为:只含有Fe2+;
②设计实验方案验证假设3:须验证Fe3+和Fe2+,步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管I、II备用,二价铁离子浅绿色,三价铁离子棕黄色,所以预期现象和结论是溶液有颜色;步骤二:往试管I中,滴加少量的KSCN溶液,溶液呈现血红色,则说明原溶液中含有 Fe3+;步骤三:往试管II滴加到少量的 KMnO4溶液,Fe2+能还原高锰酸根离子,若溶液褪色,则说明原溶液中含有 Fe2+,结合步骤二,则假设3正确,故答案为:
| 滴入几滴KSCN溶液 | 溶液呈现血红色 |
| 滴入少量KMnO4溶液(或先滴入几滴稀硫酸) | 紫红色变浅或消褪 |
点评 本题主要考查了实验方案的设计,依据铁与浓硫酸反应的原理是解答的关键,题目较难.


科目:高中化学 来源: 题型:选择题
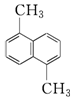 物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )
物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
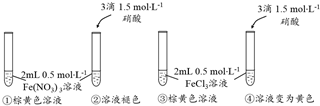
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+=Zn2++Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 变蓝色 | 2Fe3++2I-=2Fe2++I2 | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
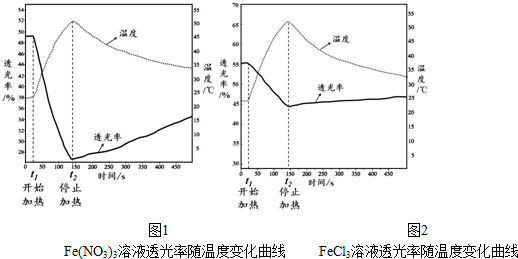
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
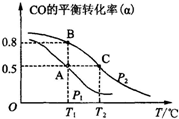 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
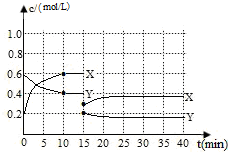 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化查看答案和解析>>
科目:高中化学 来源: 题型:解答题
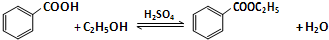
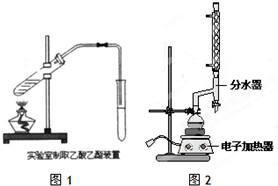
| 物质 | 颜色状态 | 密度/g/cm3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.5 L该溶液中钠离子的物质的量浓度为0.1 mol/L | |
| B. | 1 L该溶液中含有Na2CO3的质量为10.6 g | |
| C. | 从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol/L | |
| D. | 取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com