
下图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去)。
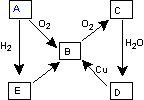 (1)A单质的电子式
(1)A单质的电子式
(2)写出E生成B的化学方程式:
。
(3)①写出由D生成B的离子方程式 。
②常温下D和E恰好完全反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
将总物质的量 为n mol的钠和铝的混合物(其中钠的物质的量分数为x),投入到一定量的水中充分反应,金属没有剩余,共收
为n mol的钠和铝的混合物(其中钠的物质的量分数为x),投入到一定量的水中充分反应,金属没有剩余,共收 集到标准状况下的气体V L。下列关系式中正确的是 ( )。
集到标准状况下的气体V L。下列关系式中正确的是 ( )。
A.x= B.0<x≤0.5
C.V=33.6n(1-x) D.11.2n<V≤22.4n
查看答案和解析>>
科目:高中化学 来源: 题型:
硅、镁已发展成当今社会重要的工程材料。
金属镁的冶炼有多种方法,其中之一以白云石(主要成分为CaCO3•MgCO3)为原料,用硅铁合金参与置换得到镁单质,反应工艺流程如下:
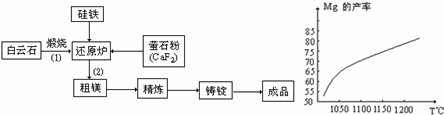
①镁在周期表中的位置为
②萤石粉作为活性剂,可增强冶炼过程中的打渣能力,CaF2的电子式为 ③写出还原炉中高温下发生置换反应的化学方程式 ; 在冶炼过程中反应温度对生成金属镁的影响如上图,从图中分析,该还原反应属于 (填“吸热”或“放热”)反应;
硅烷(SiH4)与甲烷结构相似,二者中较为稳定的是 (填化学式);
下列说法正确的是
A.相同温度下,Mg(OH)2在氨水中的Ksp小于溶解在纯水中的Ksp;
B.玻璃、水泥、陶瓷、光导纤维等都是常见的硅酸盐材料;
C.鉴于MgO和SiO2熔点均较高,故均可用于高温耐火材料
D.向含Fe3+的MgCl2溶液中加入适量MgO ,可有效除去其中的Fe3+
现取白云石100g进行冶炼,已知冶炼过程中,Mg元素的利用率为75%,得成品镁7.2g,则白云石中,CaCO3的质量分数为
查看答案和解析>>
科目:高中化学 来源: 题型:
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气 中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+,则下列说法中正确的是( )
A.铈的冶炼方法为:用稀土串级萃取法对矿石进行萃取富集;然后电解熔融的CeO2
B.CeO2溶于氢碘酸的化学方程式可表示为: CeO2+4HI=CeI4+2H2O
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.四种稳定的核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是( )
A.CO2 B.NH3 C. C12 D.H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应A + B = C + D 在低温下不能自发进行,在高温下能自发进行,对该反应过程△H、
△S的判断正确的是
A.△H <0 △S >0 B.△H >0 △S >0
 C.△H <0 △S <0 D.△H >0 △S <0
C.△H <0 △S <0 D.△H >0 △S <0
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表。下列说法错误的是

A.反应达到平衡时,X的转化率为50%
B.改变温度可以改变此反应的平衡常数
C.反应可表示为X+3Y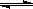 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A.两位美国科学家和一位德国科学家因研制出超分辨率荧光显微镜而共享了2014年诺贝尔化学奖
B.大雾天气常造成机场封闭、飞机航班延误,气象中的雾属于胶体
C.借助仪器分析化学物质的组成是常用的手段,原子吸收光谱常用确定物质中含有哪些非金属元素
D.同位素的应用已遍及各个领域,在医疗上利用同位素的放射性治疗肿瘤
查看答案和解析>>
科目:高中化学 来源: 题型:
对已经达到化学平衡的反应:COCl2(g) 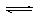 CO(g) + Cl2(g),△H>0 当反应达到平衡时下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减小压强 ⑤加催化剂,其中能提高COCl2(g)转化率的是 ( )
CO(g) + Cl2(g),△H>0 当反应达到平衡时下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减小压强 ⑤加催化剂,其中能提高COCl2(g)转化率的是 ( )
A.①⑤ B.①④ C.②③ D.③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com