
 A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表| 元素 | A | B | C | D | E |
| 性质或 结构 信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 地壳中含量最多的金属元素 | 其单质和化合物的焰色反应均为黄色 | 单质在常温、常压下是黄绿色气体 |
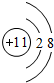 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: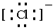 .
.分析 A原子核内只有1个质子,则A为H元素;B元素单质在空气中体积含量最多,则B为N元素;C是地壳中含量最多的金属元素,则C为Al;D元素单质和化合物的焰色反应均为黄色,则D为Na;E的单质在常温、常压下是黄绿色气体,则E为Cl.
解答 解:A原子核内只有1个质子,则A为H元素;B元素单质在空气中体积含量最多,则B为N元素;C是地壳中含量最多的金属元素,则C为Al;D元素单质和化合物的焰色反应均为黄色,则D为Na;E的单质在常温、常压下是黄绿色气体,则E为Cl.
(1)D离子为Na+,离子结构示意图: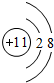 ,B为N元素,N原子的电子式:
,B为N元素,N原子的电子式: ,E离子为Cl-,电子式为:
,E离子为Cl-,电子式为: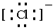 ,故答案为:
,故答案为: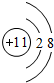 ;
; ;
;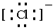 ;
;
(2)和N的氢化物所含电子数相同的微粒:CH4、H2O、HF、Ne、O2-、F-等,故答案为:CH4、H2O、HF;
(3)A元素与E元素组成的化合物为HCl,电离方程式:HCl=H++Cl-,故答案为:HCl=H++Cl-;
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是钾元素的(平均)相对原子质量;钾元素的离子的电子式:K+,故答案为:钾元素的(平均)相对原子质量;K+;
(5)硼(B)有两种同位素105B和115B,它们的原子百分数分别为19.7%和80.3%,则硼的平均相对原子质量为:10×19.7%+11×80.3%,故答案为:10×19.7%+11×80.3%.
点评 本题考查结构性质位置关系应用、元素周期表、常用化学用语、相对原子质量等,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: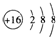 | B. | 中子数为10的氧原子:${\;}_{18}^{8}$O | ||
| C. | HClO的电子式: | D. | 硝基苯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有0.4mol电子转移,则在标准状况下消耗2.24L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 0 | 0 | 2 | 吸收热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;A→F
;A→F
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
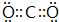 .
.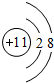 ,D、E结合形成的化合物的电子式
,D、E结合形成的化合物的电子式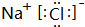 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH值为1的溶液 Fe3+、NH4+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液 Fe2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13 mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO2是还原产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | 1molKClO3参加反应,转移电子物质的量为1mol | |
| D. | 生成5.6LCO2,转移的电子数目为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 用加热的方法可除去KNO3溶液中混有的FeCl3 | |
| D. | Na2CO3溶液加水稀释后,恢复至室温,pH和Kw均减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com