
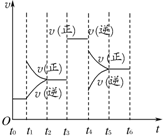
 在一密闭容器中发生下列反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系.回答下列问题:
在一密闭容器中发生下列反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系.回答下列问题:分析 (1)正逆反应速率相等时该反应达到平衡状态;
(2)t1时刻,改变条件时,正反应速率增大、逆反应速率不变,说明改变的条件是物质浓度;
该反应前后气体物质的量之和减小,t3时刻,改变条件时正逆反应速率仍然相等,改变的条件是催化剂;
t4时刻,改变条件时,正逆反应速率都减小,但正反应速率大于逆反应速率,平衡正向移动,改变的条件是温度.
解答 解:(1)正逆反应速率相等时该反应达到平衡状态,根据图知,化学平衡状态是t0-t1、t2-t4(或t2-t3、t3-t4)、t5-t6,
故答案为:t0-t1、t2-t4(或t2-t3、t3-t4)、t5-t6;
(2)t1时刻,改变条件时,正反应速率增大、逆反应速率不变,平衡正向移动,说明改变的条件是增大反应物浓度;
该反应前后气体物质的量之和减小,t3时刻,改变条件时正逆反应速率仍然相等,改变的条件是催化剂;
t4时刻,改变条件时,正逆反应速率都减小,但正反应速率大于逆反应速率,平衡正向移动,改变的条件是降低温度,
故答案为:增大反应物浓度;使用催化剂;降温.
点评 本题考查图象分析,为高频考点,明确改变条件时正逆反应速率相对大小及原平衡曲线关系、化学方程式特点是解本题关键,灵活运用外界条件对化学平衡移动影响、化学反应速率影响来分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
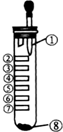 氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )
氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )| A. | 产生氯气的离子方程式:16H++10Cl-+2MnO${\;}_{4}^{-}$=2Mn2++5Cl2↑+8H2O | |
| B. | ⑦处变血红色,是因为2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3 | |
| C. | ②褪色,③处先变红后褪色,⑤处出现淡黄色固体 | |
| D. | ④处变蓝,⑥处变橙红,能说明氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T(℃) | NO初始浓(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
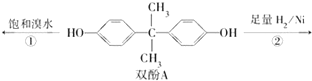 用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )| A. | 双酚A的分子式是C15H16O2 | |
| B. | 反应①中,1 mol双酚A最多消耗2 mol Br2 | |
| C. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| D. | 反应②的产物中只有一种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(N2)=0.25mol/(L•min) | B. | υ(H2)=0.75mol/(L•min) | ||
| C. | υ(NH3)=1mol/(L•min) | D. | υ(NH3)=0.5mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
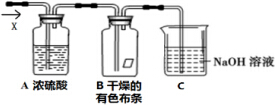 某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
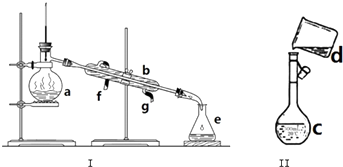
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
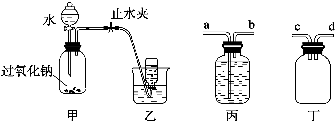
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com