
| A. | HCO3-+H2O?CO32-+H3O+ | B. | HCO3-+OH-?CO32-+H2O | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | S2-+2H2O?H2S+2OH- |
分析 水解是指盐电离产生的弱离子结合水电离产生的氢离子生成弱酸或者弱碱,据此分析解答.
解答 解:A.HCO3-+H2O?CO32-+H3O+为碳酸氢根离子的电离,不是水解离子方程式,故A不选;
B.HCO3-+OH-?CO32-+H2O,为碳酸氢根离子的电离,不是水解离子方程式,故B不选;
C.碳酸氢根离子为弱酸对应的酸式根离子,能够与水电离产生的氢离子结合生成碳酸,水解离子方程式为:HCO3-+H2O?H2CO3+OH-,故C选;
D.硫离子为多元弱酸的酸根离子,分步水解,水解离子方程式:S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,故D不选;
故选:C.
点评 本题考查了离子方程式书写,侧重考查盐类水解的离子方程式书写,明确盐类水解的实质是解题关键,注意多元弱酸的酸根离子分步水解,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用金属钠或金属钾 | B. | 利用质谱法 | ||
| C. | 利用红外光谱 | D. | 利用核磁共振氢谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.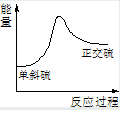
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 4.7 | 3.4 |
| 沉淀完全的pH | 3.2 | 6.7 | 4.7 |
| A. | 该温度下Ksp[Fe(OH)3]=1×10-14.6 | |
| B. | W主要含有 Cu(OH)2和Al(OH)3 | |
| C. | 溶液X中一定含有Cu2+、Fe3+和SO42- | |
| D. | 取溶液Y进行焰色反应,可判断溶液X中是否含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
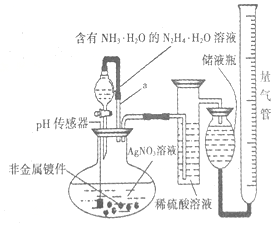 化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):
化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略): .已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.
.已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com