
用NA代表阿伏加德罗常数.下列说法正确的是( )
|
| A. | 9g重水(D2O)中所含质子数为0.5×6.02×1023 |
|
| B. | 电解精炼铜时,每转移l mol电子,阳极上溶解的金属必为32g |
|
| C. | 往存在V2O5的密闭容器中加入2molSO2和lmolO2,充分反应后分子总数等于2NA |
|
| D. | VL a mol•L﹣1的氯化铁溶液中,若Fe3+的数目为NA,则Cl﹣的数目大于3NA |
| 阿伏加德罗常数.. | |
| 分析: | A.重水的摩尔质量为20g/mol,重水中含有10个质子,9g重水的物质的量为0.45mol,含有4.5mol质子; B.由于粗铜中含有活泼性较强的铁锌等杂质,电解时铁锌原先放电,所以转移1mol电子,溶解的铜的物质的量小于0.5mol; C.二氧化硫与氧气的反应为可逆反应,反应物不可能完全转化成生成物; D.氯化铁溶液中,铁离子部分水解,铁离子数目小于氯离子. |
| 解答: | 解:A.9g重水的物质的量为0.45mol,0.45mol重水中含有4.5mol质子,含质子数为4.5×6.02×1023,故A错误; B.电解精炼铜时,粗铜中含有杂质铁锌等活泼金属杂质,会比铜先失电子,所以每转移lmol电子,阳极上溶解的金属质量不一定是32g,故B错误; C.往存在V2O5的密闭容器中加入2molSO2和lmolO2,该反应为可逆反应,并不会完全生成三氧化硫,反应后分子的物质的量大于2mol,分子总数大于2NA,故C错误; D.氯化铁溶液中铁离子部分水解,所以溶液中氯离子数目大于铁离子数目的三倍,若Fe3+的数目为NA,则Cl﹣的数目大于3NA,故D正确; 故选D. |
| 点评: | 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C为易错点,注意可逆反应的特点. |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
Fe(OH)3胶体区别于FeCl3溶液最本质的特点是( )
A.Fe(OH)3胶体粒子的大小在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一、稳定的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
|
| A. | 标准状况下,11.2 L乙烯含有的极性共价键数为NA |
|
| B. | 常温下,5.6 L NO和5.6 L O2的混合气体中含有的分子数为0.5NA |
|
| C. | 16.9 g BaO2固体中阴、阳离子总数为0.2NA |
|
| D. | 含有1 mol Fe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种燃料电池:A.固体氧化物燃料电池,B.碱性氢氧化物燃料电池,C.质子交换膜燃料电池,D.熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
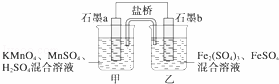
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol•L﹣1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.回答下列问题:
(1)此原电池的正极是石墨 (填“a”或“b”),发生 反应.
(2)电池工作时,盐桥中的SO42﹣移向 (填“甲”或“乙”)烧杯.
(3)两烧杯中的电极反应式分别为
甲 ,
乙 .
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5mol•L﹣1,则反应中转移的电子为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )

|
| A. | Z元素的原子半径可能比Y元素的小 |
|
| B. | W的原子序数可能是Y的原子序数的2倍 |
|
| C. | W的气态氢化物的稳定性一定比Y的强 |
|
| D. | Z的化学活泼性一定比X强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
|
| A. | pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH﹣)=c(H+) |
|
| B. | 在0.1 mol•L﹣1Na2CO3溶液中:c(OH﹣)﹣c(H+)=c(HCO3﹣)+2c(H2CO3) |
|
| C. | 已知叠氮酸(HN3)与醋酸酸性相近,则在NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(OH¯)>c(N3¯)>c(H+) |
|
| D. | 0.2 mol•L﹣1NaHCO3溶液中加入等体积0.1 mol•L﹣1NaOH溶液:c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
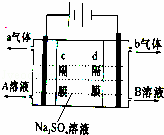
双隔膜电解池的结构示意简图如图所示,对该装置及其原理判断错误的是
( )
|
| A. | c隔膜为阴离子交换膜、d隔膜为阳离子交换膜 |
|
| B. | A溶液为硫酸,B溶液为氢氧化钠 |
|
| C. | a气体为氢气,b气体为氧气 |
|
| D. | 该电解反应的总方程式为:2Na2SO4+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某透明溶液中可能含有Fe2+、Fe3+、Al3+、NH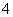 、Cl-、I-、NO
、Cl-、I-、NO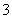 、SO
、SO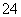 (H+、OH-没有列出)中的一种或几种,为了确认溶液中离子的存在情况,分别取等量的试液装入5支试管里,做如下实验:
(H+、OH-没有列出)中的一种或几种,为了确认溶液中离子的存在情况,分别取等量的试液装入5支试管里,做如下实验:
①测定溶液pH,pH=2;②向溶液中滴加过量氢氧化钠溶液,过滤、洗涤、灼烧、称重,得固体质量为3.2 g;③向溶液中加入过量浓氢氧化钠溶液,加热,收集到气体1.12 L(标准状况);④向溶液中加入足量的氯化钡溶液,过滤、洗涤、干燥、称重,得固体2.33 g;⑤向溶液中加入适量浓硫酸,再加入铜粉,振荡溶液,产生红棕色气体。下列对实验结论的分析合理的是 ( )
A.可能存在Al3+、Fe2+
B.只存在NO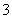 、NH
、NH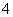 、SO
、SO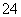 、Fe3+
、Fe3+
C.一定不存在Cl-、I-
D.可能存在Al3+、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com