
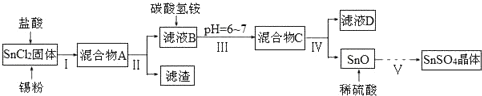
分析 (1)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢铵,调节溶液pH,使Sn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NH4Cl等.
①加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化;
②步骤Ⅱ为过滤;沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-;
③步骤Ⅴ是用硫酸溶解后,从溶液中获得晶体,滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥,制得SnSO4晶体;
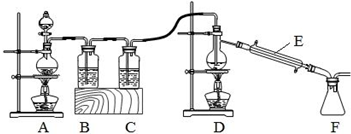
(2)由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,A制备氯气,B中盛放饱和氯化钠反应,除外HCl,C中盛放浓硫酸,干燥氯气,D中Sn与氯气反应生成SnCl4,F收集SnCl4.
①装置C中应加入的试剂为浓硫酸,仪器E的名称为冷凝管;
②熔融的金属锡与氯气反应过程中放出大量的热,能维持该反应继续进行;
③需要用温度计;需要防止空气中水蒸气加入F中.
解答 解:(1)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢铵,调节溶液pH,使Sn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NH4Cl等.
①加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,
故答案为:调节溶液pH,还防止Sn2+被氧化;
②步骤Ⅱ为过滤,用到的玻璃仪器除烧杯外还有漏斗、玻璃棒,
沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-,具体方案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀生成,说明洗涤干净
故答案为:漏斗、玻璃棒;滴加稀硝酸和AgNO3溶液,无白色沉淀生成;
③步骤Ⅴ是用硫酸溶解后,从溶液中获得晶体,滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥,制得SnSO4晶体,操作顺序为:cdabe,
故答案为:cdabe;
(2)由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,A制备氯气,B中盛放饱和氯化钠反应,除外HCl,C中盛放浓硫酸,干燥氯气,D中Sn与氯气反应生成SnCl4,F收集SnCl4.
①装置C中应加入的试剂为浓硫酸,仪器E的名称为冷凝管,故答案为:浓硫酸;冷凝管;
②熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行,可以先熄灭D处的酒精灯,
故答案为:D;熔融的金属锡与氯气反应过程中放出大量的热,能维持该反应继续进行;
③需要温度计;在装置F后应连接一个装有碱石灰(或氢氧化钠固体)的干燥管,需要防止空气中水蒸气加入F中,
故答案为:需要温度计;在装置F后应连接一个装有碱石灰(或氢氧化钠固体)的干燥管.
点评 本题可知物质制备方案、化学工艺流程等,是对学生综合能力的考查,需要学生具备扎实的基础,注意对题目信息的运用,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
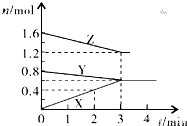 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随间变化的曲线如图所示.由图中数据分析
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随间变化的曲线如图所示.由图中数据分析查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
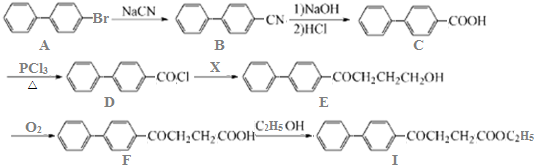
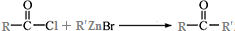
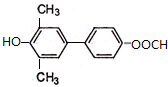 .
.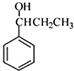 )为强效利胆药,请写出以甲苯和C2H5ZnBr为原料制备苯丙醇的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
)为强效利胆药,请写出以甲苯和C2H5ZnBr为原料制备苯丙醇的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏常用于分离提纯液态有机混合物,温度计的水银球应位于支管口附近 | |
| B. | 核磁共振氢谱通常用于分析有机物的相对分子质量 | |
| C. | 燃烧法通常是研究和确定有机物成分的有效方法之一 | |
| D. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com