
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
 ;
;分析 X、Y、Z、W、J是元素周期表前四周期中的五种常见元素,其中X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,原子核外电子排布式为1s22s22p2,则X为C元素;Y元素原子的M层上有2对成对电子,原子核外电子排布式为1s22s22p63s23p4,则Y为S元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl;W的一种核素的质量数为63,中子数为34,其质子数为63-34=29,故W为Cu;J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐,则J为N元素.
解答 解:X、Y、Z、W、J是元素周期表前四周期中的五种常见元素,其中X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,原子核外电子排布式为1s22s22p2,则X为C元素;Y元素原子的M层上有2对成对电子,原子核外电子排布式为1s22s22p63s23p4,则Y为S元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl;W的一种核素的质量数为63,中子数为34,其质子数为63-34=29,故W为Cu;J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐,则J为N元素.
(1)元素X(碳)的一种同位素可测定文物年代,该同位素质量数为14,这种同位素的符号是:146C,
故答案为:146C;
(2)元素Y原子的核外电子排布式为1s22s22p63s23p4,位于元素周期表第三周期第VIA族,
故答案为:三、VIA;
(3)元素Z为Cl,原子最外层有7个电子,故原子最外层共有7种不同运动状态的电子;基态Z原子中,电子占有的最高能层符号为3p,
故答案为:7;3p;
(4)W为Cu,外电子排布式是:1s22s22p63s23p63d104s1,W的基态原子核外价电子排布图是: ,
,
故答案为:1s22s22p63s23p63d104s1; ;
;
(5)同周期自左而右非金属性增强,故Cl的非金属性比硫的强,
a.单质状态属于物理性质,不能比较非金属性强弱,故a错误;
b.电负性越大非金属性越强,Z的电负性大于Y,说明Z的非金属性更强,故b正确;
c.氢化物稳定性与元素非金属性一致,故c正确;
d.非金属性强弱与获得电子难易程度有关,与获得电子数目多少无关,故d错误;
e.元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,故e正确,
故答案为:Cl;bce;
(6)J的元素名称为氮,在周期表中位于p区.J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的离子方程式:NH3+H+=NH4+,
故答案为:氮;p;NH3+H+=NH4+.
点评 本题考查原子结构与元素周期律,元素的推断是解答的关键,熟练掌握金属性、非金属性强弱比较实验事实.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
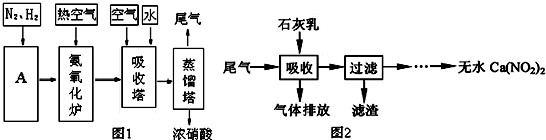
 CO+3H2.
CO+3H2.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
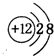 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com