
| A. | 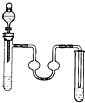 苯的溴代反应 | B. |  乙酸丁酯的制备 | C. |  苯的硝化反应 | D. |  乙炔的制取 |
分析 A.苯和液溴在溴化铁作催化剂条件下能生成溴苯,溴易挥发且有毒,溴易溶于NaOH溶液中,有缓冲装置的能防止倒吸;
B.在浓硫酸作催化剂、加热条件下丁醇和乙酸发生酯化反应生成乙酸丁酯,用饱和碳酸钠溶液分离乙酸丁酯;
C.苯和浓硝酸在浓硫酸作催化剂、加热55-60℃条件下制取硝基苯;
D.实验室用饱和食盐水和碳化钙固体制取乙炔.
解答 解:A.苯和液溴在溴化铁作催化剂条件下能生成溴苯,溴易挥发且有毒,溴易溶于NaOH溶液中,有缓冲装置的能防止倒吸,苯和液溴是液体、铁是固体,所以可以用分液漏斗和试管作为发生装置,中间装置能防止倒吸,用NaOH溶液吸收挥发的溴和生成的HBr,则可以实现实验目的,故A正确;
B.在浓硫酸作催化剂、加热条件下丁醇和乙酸发生酯化反应生成乙酸丁酯,用饱和碳酸钠溶液分离乙酸丁酯,需要直接加热而不是水浴加热,故B错误;
C.苯和浓硝酸在浓硫酸作催化剂、加热55-60℃条件下制取硝基苯,温度小于100℃,需要水浴加热,故C正确;
D.实验室用饱和食盐水和碳化钙固体制取乙炔,实验可以用分液漏斗盛放液体,用烧瓶盛放碳化钙,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、尾气处理等知识点,明确实验原理、实验操作、物质性质是解本题关键,知道常见仪器的用途,熟悉常见物质制备原理,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 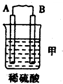 | 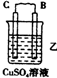 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
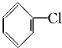
| A. | 产物乙的系统命名为2-甲基丁烷 | |
| B. | 烃甲可能是2-甲基-1,3-丁二烯 | |
| C. | 0.1 mol产物乙完全燃烧可消耗17.92L O2 | |
| D. | 烃甲与乙炔可能是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量 | |
| B. | 1mol氢气与1mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 在相同条件下,1mol氢气与1 mol氟气的总能量大于2mol氟化氢气体的能量 | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 制取
制取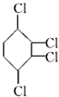 ,其合成流程如下:
,其合成流程如下:
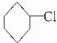 .
. ,
,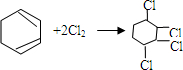 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
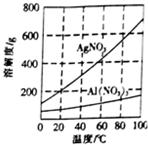 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com