
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Na+、SO32-、SO42-
B.1.0mo1·L-1的CH3COOH溶液:K+、Fe3+、NO3-、Cl-
C.在![]() =l×l012的溶液:NH4+、Ca2+、Cl-、K+
=l×l012的溶液:NH4+、Ca2+、Cl-、K+
D.甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32-
【答案】B
【解析】
A. 水电离的c(H+)=1×10-13mol·L-1的溶液为酸性或碱性溶液,SO32-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故A错误;
B. K+、Fe3+、NO3-、Cl-之间不反应,都不与CH3COOH反应,在溶液中能够大量共存,故B正确;
C.室温下 ![]() =l×l012,由于c(H+)·c(OH-)= l×l0-14,说明溶液中存在大量氢氧根离子,NH4+与氢氧根离子反应,在溶液中不能大量共存,故C错误;
=l×l012,由于c(H+)·c(OH-)= l×l0-14,说明溶液中存在大量氢氧根离子,NH4+与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D. 甲基橙显黄色的溶液的pH大于4.4,可能为酸性或碱性溶液,CO32-、SO32-与氢离子反应,NO3-、SO32-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制98 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为 ______ mL。
(2)实验时选用的仪器有(填序号)_______
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_____
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
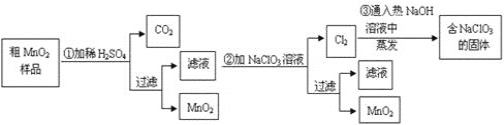
(1)第①步加稀H2SO4时,粗MnO2样品中的____(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式:_________
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯 、______、______,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有____(写物质名称)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,过滤得到8.7 gMnO2,并收集到0.224 L CO2(标准状况),则第②步反应中至少需要_______ g NaClO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.在金刚石晶体中,最小碳原子环由6个碳原子构成
C.在石墨晶体中,每个环上平均占有3个碳原子
D.银晶体晶胞如图,银原子的配位数为12
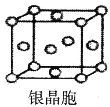
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
【答案】 NaHSO4=Na++H++SO42- 酸 Al2O3 Fe2++2H2OFe(OH)2+2H+ 抑制Fe2+水解 防止Fe2+氧化 1.0×10-12 11
【解析】(1). NaHSO4是强酸的酸式盐,在水溶液中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2).AlCl3是强酸弱碱盐,水解使溶液呈酸性;Al3++3H2O![]() Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3
Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3 ![]() Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
(3).实验室配制FeSO4溶液,因亚铁离子发生水解:Fe2++2H2O![]() Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O
Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O![]() Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
(4).① . t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,则Kw= c(H+)×c(OH-)= 10-a mol·L-1×10-b mol·L-1=1.0×10-(a+b),已知a+b=12,则Kw=1.0×10-12,故答案为:1.0×10-12;
②在该温度下,100mL 0.1 mol·L-1的稀H2SO4溶液中n(H+)=0.1L×0.1 mol·L-1×2=0.02mol,100mL 0.4 mol·L-1的NaOH溶液中n(OH-)=0.1L×0.4 mol·L-1=0.04mol,两溶液混合后氢氧根离子过量,所得溶液中c(OH-)=![]() = 0.1mol/L,则c(H+)=
= 0.1mol/L,则c(H+)=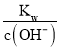 =10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
=10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
【题型】综合题
【结束】
24
【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是
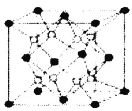
A.铁镁合金的化学式为Mg2Fe
B.晶体中存在的化学键类型为共价键
C.晶格能:氧化镁>氧化钙
D.该晶胞的质量是![]() g(NA表示阿伏加德罗常数的值)
g(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计制备草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下:
I.FeCl3的制备。
某小组用氯气与金属铁反应制备无水三氯化铁,并设计(Ⅰ)和(Ⅱ)两套不同的收集方案。已知FeCl3呈棕红色、易潮解,100℃左右时升华。
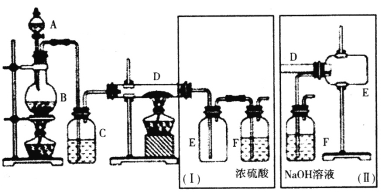
(1)B中反应的离子方程式为___。
(2)(Ⅰ)和(Ⅱ)中装置F的作用分别是___;___。
如果选用(Ⅱ)来完成实验,则必须采取的改进措施是___。
Ⅱ.利用FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]。制备流程如图所示:
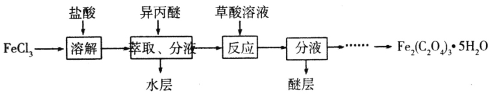
已知:异丙醚是微溶于水的液体,FeCl3在异丙醚中的溶解度比在水中大;草酸铁能溶于水和酸,不溶于醇和醚。
(1)上述流程中FeCl3能被异丙醚萃取,其原因是__;萃取所用的主要实验仪器为___;从反应后溶液中分离并获得Fe2(C2O4)3·5H2O的实验步骤为__。
(2)检验萃取、分液后所得水层中是否含有Fe3+,可选用的试剂为___。
Ⅲ.测定草酸铁晶体Fe2(C2O4)3·5H2O中铁的含量。
(1)称量m g样品于锥形瓶中,加水溶解,用cmol·L-1KMnO4溶液(H2SO4酸化)滴定至终点,其反应离子方程式为___。
(2)向上述溶液中加入过量锌粉,充分反应后过滤、洗涤,将滤液及洗涤液收集到锥形瓶中。
(3)用cmol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为___%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. “春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是蛋白质和烃
B. 淀粉、纤维素、麦芽糖在一定条件下可和水作用转化为葡萄糖
C. 全降解塑料![]() 可由环氧丙烷
可由环氧丙烷![]() 和CO2缩聚制得
和CO2缩聚制得
D. 皂化反应是指油脂在稀硫酸的作用下水解得到高级脂肪酸和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
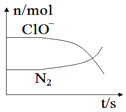
A.该反应中Cl-为氧化产物
B.消耗1mol还原剂,转移6mol电子
C.反应后溶液的酸性减弱
D.氧化剂与还原剂物质的量之比为3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com