
【题目】碳原子数小于 6 的烷烃中,一氯代物只有一种的有
A. 2 种 B. 3 种 C. 4 种 D. 5 种
科目:高中化学 来源: 题型:
【题目】EHPB是合成治疗高血压和充血性心力衰竭的药物的中间体,合成路线如下:
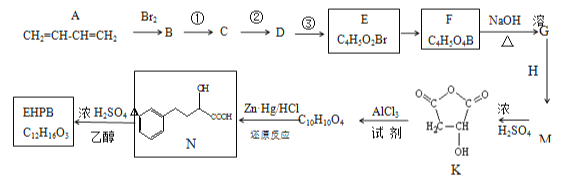
已知:ⅰ.碳碳双键容易被氧化
ⅱ. ![]()
(1)A的名称为______,E中含氧官能团的名称为_______。
(2)E由B经①、②、③合成。
a.①的反应试剂和条件是__。 b.③ 的反应类型是______。
(3)M的结构简式为__________。
(4)EHPB不能与NaHCO3反应,写出有机物N→EHPB的化学方程式为_____________。
(5)有机物N有多种同分异构体,其中能满足下列条件的同分异构体有_________种。
a.含有酚羟基 b.能发生水解反应且能发生银镜反应c.苯环上的一氯代物只有一种 d.核磁共振氢谱有5组峰
(6)请写出由苯和乙二醇制取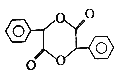 的转化过程________,无机试剂任选。
的转化过程________,无机试剂任选。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 过氧化钠与反应:2O22-+2H2O=4OH-+O2↑
C. 碳酸氢钠与稀盐酸反应:CO32-+2H+=CO2↑+ H2O
D. 氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是( ) ①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料.
A.①②
B.②③
C.①④
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡是一种银白色金属,在生产、生活中有着重要的用途,在化合物中主要呈现+2和+4价。
(l)我国云南个旧锡矿闻名于世,其主要成分为SnO2。用焦炭作还原剂,在高温下用该矿石可制得粗锡,该反应的化学方程式为___________。
(2)马口铁是在铁皮表面镀一层金属锡。马口铁破损后,负极上的电极反应是_______。
(3)锡的氯化物有SnCl2和SnCl4。SnCl2是生产和化学实验中常用的还原剂,易发生水解;SnCl4常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃。
① 若实验室中以SnCl2固体配制SnCl2溶液,试简述操作方法________。
②SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为_______。
(4)Sn(OH)2具有明显的两性,在碱性条件下以Sn(OH)3的形式存在。写出Sn(OH)2发生酸式电离的电离方程式____________。
(5)SnS2是黄色固体,俗称“金粉”,将H2S通入SnCl4溶液中可得SnS2沉淀,写出该反应的离子方程式__________。
(6)某同学对微电子器件生产的锡粉设计如下方法进行纯度测定:① 取试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;② 加人过量的Fe2(SO4)3溶液;③ 用0.10mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价);④ 根据数据计算出锡粉的纯度。步骤② 中加入Fe2(SO4)3的作用是_______;用离子方程式表示K2Cr2O7溶液进行滴定实验的原理__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是
A. 碱性氧化物:Na2O、CaO、MgO、
B. 碱:纯碱、烧碱、熟石灰、苛性钠
C. 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D. 氧化物:CO2、NO、SO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:

已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com