
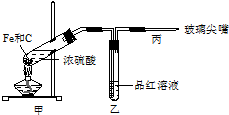
 (1)下列仪器在使用前必须检查其是否漏水的是
(1)下列仪器在使用前必须检查其是否漏水的是
| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、它的质子数一定是18 |
| B、它的原子和37Cl可能互为同位素 |
| C、它的单质一定是强还原剂 |
| D、可以确定该微粒为Ar |
查看答案和解析>>
科目:高中化学 来源: 题型:
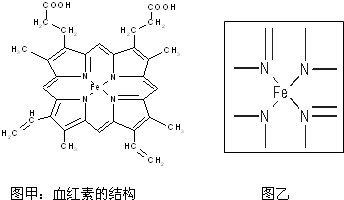
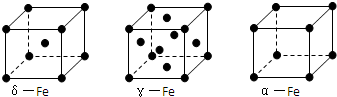
查看答案和解析>>
科目:高中化学 来源: 题型:
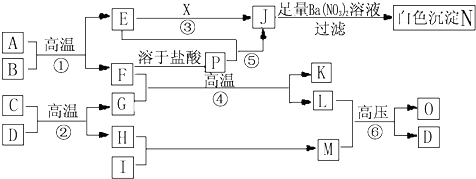
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中的乙酸,可以用饱和的碳酸钠溶液 |
| B、配制溶液时,俯视刻度线来定容,会使得所配溶液浓度偏高 |
| C、用托盘天平称取8.7克食盐 |
| D、实验室可以用新制氢氧化铜悬浊液来检验甘油,观察到的现象是出现绛蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
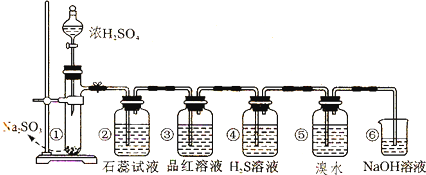
查看答案和解析>>
科目:高中化学 来源: 题型:
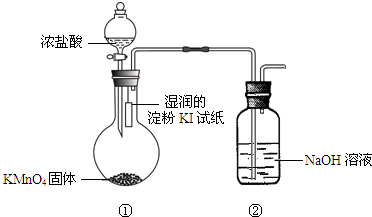 欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).
欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com