
| A. | 当pH=7时,c(Na+ )=c(CH3 COO- )>c(H+ )=c(OH- ) | |
| B. | 当pH>7时,c(CH3 COO- )>c(Na+ )>c(OH- )>c(H+ ) | |
| C. | 当恰好完全中和时,c(Na+ )>c(CH3 COO- )>c(OH- )>c(H+ ) | |
| D. | 无论溶液显什么性都有关系:c(Na+ )+c(H+ )=c(CH3 COO- )+c(OH- ) |
分析 A.当pH=7时,c(H+)=c(OH-),结合电荷守恒判断;
B.阴离子浓度之和大于阳离子浓度之和,不能满足溶液电中性;
C.当恰好完全中和时,恰好生成醋酸钠,溶液呈碱性;
D.从溶液的电中性原则分析.
解答 解:A.当pH=7时,c(H+)=c(OH-),溶液存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-),中性溶液中氢离子或氢氧根离子浓度较小,则c(CH3COO-)>c(H+),所以有c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故A正确;
B.阴离子浓度之和大于阳离子浓度之和,不能满足溶液电中性,应为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),如NaOH过量较多时存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故B错误;
C.当恰好完全中和时,恰好生成醋酸钠,溶液呈碱性,存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;
D.溶液存在电荷守恒,则有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故D正确.
故选B.
点评 本题考查离子浓度的大小比较,题目难度中等,本题注意溶液电中性原则的应用.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 陶瓷餐具 | B. | 石英钟表 | C. | 计算机芯片 | D. | 光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化 | |
| B. | “曾青得铁化为铜”发生了化学变化 | |
| C. | “滴水石穿、绳锯木断”不包含化学变化 | |
| D. | “卤水点豆腐,一物降一物”的前半句话与胶体知识有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ③ | ④ | ⑧ | |||||
| 3 | ② | ⑤ | ⑥ | |||||
| 4 | ⑦ |

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度/ (mol•L-1) | 2 | 1 | 4 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
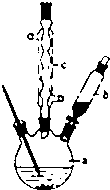 苯乙酸铜是合成优良催化剂、传感材料-纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料-纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: (苯乙腈)
(苯乙腈)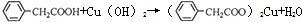
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com