
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
| 属于该类的物质 | ② | ⑧⑨ |
分析 Ⅰ.(1)根据物质的分类标准以及分类结果进行判断物质所属的类别,两种元素组成其中一种为氧元素的化合物为氧化物,分散质微粒直径1-100nm形成的分散系为胶体;
(2)在水溶液中和熔融状态下均不能导电的化合物是非电解质;盐酸是一种强酸具有酸的通性;
Ⅱ.(1)反应中,KClO3中氯元素化合价由+5价降低为0价,盐酸中,部分氯元素化合价由-1价升高为0价,以此解答该题;
(2)氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目.
解答 解:Ⅰ.(1)根据物质的元素组成,可以将物质分为纯净物和混合物,纯净物中,根据组成元素的种类可以将物质分为单质和化合物,只有一种元素组成的纯净物是单质,如氧气、铁,根据化合物的性质,可以将化合物分为酸、碱、盐、氧化物,如氧化钙、二氧化碳属于氧化物,根据混合物分散质微粒直径的大小,可以将混合物分为溶液(如硫酸钠溶液、稀硝酸)浊液和胶体(如红褐色的氢氧化铁液体)三种,化合物在水溶液或是熔融态下是否导电,可以将化合物分为电解质和非电解质,如CaO、H2SO4、Ba(OH)2、Cu2(OH)2CO3属于电解质,故答案为:
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
| 属于该类的物质 | ③④ | ⑦ |
点评 本题考查了物质分类的依据和分析判断、氧化还原反应概念和电子转移等,物质组成和性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂 | |
| B. | 25min时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡大 | |
| C. | 反应开始到第一次平衡时,N2的平均反应速率为0.0625mol•(L•min)-1,H2的转化率为75% | |
| D. | 从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
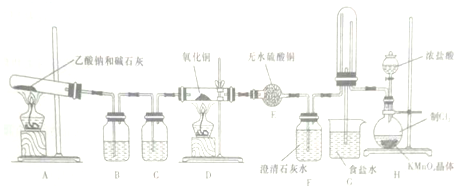
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7g的NH3中含有的质子数为0.1NA | |
| B. | 标准状况下,5.6L水含有的分子数为0.25NA | |
| C. | 标准状况下,22.4L氮气和氢气的混合物中所含的分子数为NA | |
| D. | 常温下,9.5克MgCl2中含Mg2+ 为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,可用泡沫灭火器扑灭 | |
| B. | 非金属氧化物都是酸性氧化物 | |
| C. | 金属钠与氧气反应,条件不同,则产物不同 | |
| D. | 当钠与硫酸铜溶液反应时,可观察到大量的红色固体物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
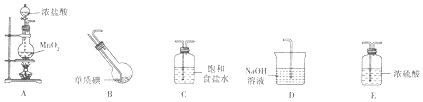
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NaCl是离子化合物 | NaCl固体可导电 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | 1-己醇的沸点比己烷的沸点高89℃ | 1-己醇和己烷可通过蒸馏初步分离 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列各项中的物质,能满足图中阴影部分关系的是( )
下列各项中的物质,能满足图中阴影部分关系的是( )| ① | ② | ③ | ④ | |
| A | NaCl | KCl | K2SO4 | NH3Cl |
| B | Na2SO4 | K2SO4 | KCl | NH3Cl |
| C | NaCl | KCl | NH3Cl | K2SO4 |
| D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成amolCaCO3 | |
| B. | 形成bmolCaCO3 | |
| C. | 可能得到CaCO3沉淀,但沉淀量小于bmol | |
| D. | 可能最终得到澄清溶液,其中含$\frac{a}{2}$molCa2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com