
| A. | 乙醇与浓H2SO4共热170℃ | B. | 乙烯使溴水褪色 | ||
| C. | 甲苯与浓硫酸、浓硝酸混合 | D. | 苯与Cl2一定条件生成六氯环己烷 |
分析 有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,以此解答该题.
解答 解:A.乙醇与浓H2SO4共热到170℃生成乙烯,属于消去反应,故A错误;
B.乙烯含有碳碳双键,发生加成反应而使溴水褪色,故B错误;
C.甲苯与浓硫酸、浓硝酸混合生成硝基苯,为取代反应,故C正确;
D.苯与Cl2光照生成六氯环己烷,属于加成反应,故D错误.
故选C.
点评 本题考查有机物的性质、有机反应类型,为高频考点,侧重考查学生的分析能力,题目难度不大,注意明确常见有机反应类型,熟练掌握取代反应与其它反应类型的区别.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
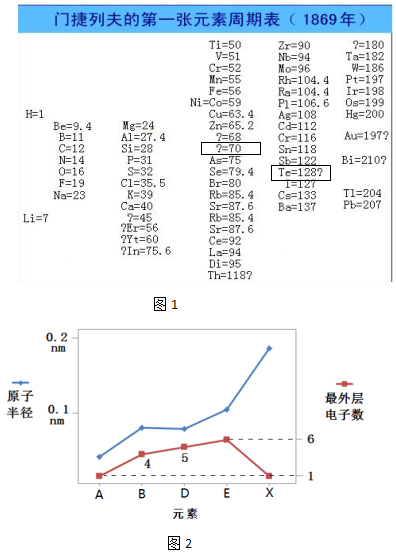
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立 近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
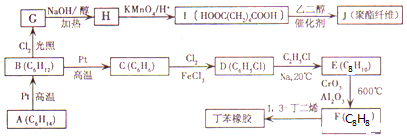
 ,写出Z元素气态氢化物的电子式:
,写出Z元素气态氢化物的电子式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入过量Fe:Fe2+、Fe3+、Cl-、H+ | |
| B. | 加入过量H2O2和稀盐酸:Fe3+、Cu2+、H+、Cl- | |
| C. | 加入过量新制氯水:Fe3+、Cu2+、H+、Cl- | |
| D. | 加入过量CuO:Fe3+、Cu2+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
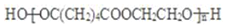 .
.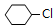 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$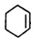 +NaCl+H2O.
+NaCl+H2O.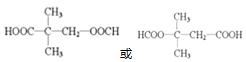 (写出其中一种的结构简式).
(写出其中一种的结构简式).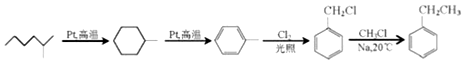 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
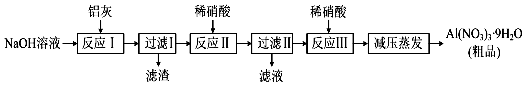
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物称为醇 | B. | 能发生银镜反应的有机物都是醛 | ||
| C. | 苯酚俗称石炭酸,酸性比碳酸强 | D. | C3H6和C4H8不一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
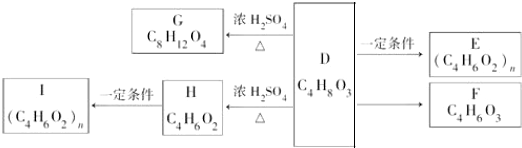
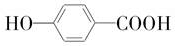 .
.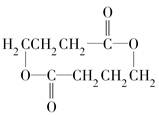 +2H2O.
+2H2O.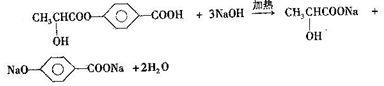 .
.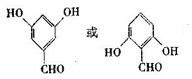 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL 2mol/L HCl | B. | 300mL 2mol/L H2SO4 | ||
| C. | 100mL 3mol/L HNO3 | D. | 500mL 18.4mol/L H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com