
 .
. 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:实验题
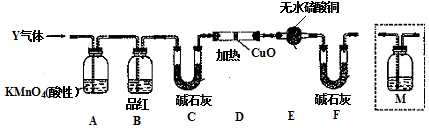
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | B. | 简单阴离子半径:X->Y2->Z3- | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 电负性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙醇可被重铬酸钾氧化成乙酸,溶液由橙色变成绿色 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲和丙均可与酸性KMnO4溶液发生反应 | |
| B. | 反应(1)的无机试剂是液溴和铁粉,实际起催化作用的是FeBr3 | |
| C. | 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲 | |
| D. | 反应(2)属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
| Ksp | 6×10-36 | 3×10-19 | ||||
| pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
| 沉淀完全 | 6.7 | 9.2 | 3.2 | |||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com