
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液不显红色.再向溶液中加入几滴新制氯水,溶液变为红色. | 该溶液中一定含有 Fe2+ |
| C | 将某气体通入到品红溶液中,品红褪色 | 该气体一定为SO2 |
| D | 向某溶液中滴入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.与氯化钡溶液反应生成的白色沉淀可能为氯化银,不一定为硫酸钡;
B.先加入硫氰化钾溶液,溶液不显示红色,说明溶液中不存在铁离子,再加入氯水后变为红色,说明此时溶液中存在铁离子,则原溶液中一定含有亚铁离子;
C.二氧化硫能够使品红褪色,但是使品红溶液褪色的不一定为二氧化硫,可能为氯气;
D.可能为HCO3-.
解答 解:A.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该白色沉淀可能为硫酸钡或氯化银,原溶液中可能含有银离子,不一定含有硫酸根离子,故A错误;
B.向某溶液中加入2滴KSCN溶液,溶液不显红色,说明原溶液中不存在铁离子,再向溶液中加入几滴新制的氯水,溶液变为红色,说明加入氯水后的溶液中存在铁离子,则证明原溶液中一定存在亚铁离子,故B正确;
C.氯气与水反应生成具有强氧化性的次氯酸,次氯酸具有漂白性;所以将某气体通入品红溶液中,品红溶液褪色,该气体不一定为二氧化硫,可能为氯气,故C错误;
D.CO32-和HCO3-都能与HCl反应生成CO2气体,CO2气体为能使澄清石灰水变浑浊的无色无味的气体,所以不能判断出是否含有CO32-,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及常见离子的检验方法判断、二氧化硫的化学性质,题目难度不大,注意掌握常见离子的化学性质及检验方法,明确能够使品红溶液褪色的气体不一定为二氧化硫,可能为氯气.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉既可作纸张的漂白剂,又可用作游泳池的消毒剂 | |
| B. | 汽车尾气中含有氮的氧化物,是由汽油不完全燃烧造成的 | |
| C. | 氧化铝、氢氧化钠、碳酸氢钠都是常见的胃酸中和剂 | |
| D. | 工业上,焦炭在高温下还原二氧化硅得到粗硅,说明碳的金属性比硅的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| B. | 在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶中,取出坩埚钳,盖上玻璃片,观察Mg条在集气瓶底部燃烧 | |
| C. | 为比较Cl与S元素非金属性强弱,相同条件下测定相同浓度NaCl溶液和Na2S溶液的pH值 | |
| D. | 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾投入水中的电离方程式为:KAI(SO4)2•12H2O=K++Al3++2SO42-+12H20,说明明矾是一种混合物 | |
| B. | 净水时Al3+发生水解生成的是Al(OH)3沉淀 | |
| C. | 明矾净水的原理是杀菌消毒 | |
| D. | 硫酸铁可以代替明矾进行净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用已脱硫的煤作燃料 | |
| B. | 大量开采地下水,以满足社会对水的需求 | |
| C. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.
化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
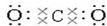 ,O=C=O.
,O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
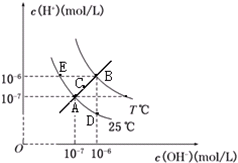
| A. | 图中五点KW间关系:B>C>A=D=E | |
| B. | E点对应的水溶液中,可能有NH${\;}_{4}^{+}$、Ba2+、Cl-、I-、K大量同时存在 | |
| C. | 若处在B点时,将pH=3的硫酸溶液与pH=9的KOH溶液等体积混合,所得溶液呈中性 | |
| D. | 若0.1mol/L的NaHB溶液中c(OH+)与c(OH-)关系如图D点所示,则溶液中有:c(HB-)>c(OH-)>c(B2-)>c(H2B) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com