
【题目】图示代表周期表中的几种短周期元素,下列说法中错误的是()

A. ED4分子中各原子均满足8电子稳定结构
B. AD3和ED4两分子的中心原子均为sp3杂化
C. C、D气态氢化物稳定性强弱为C>D
D. A、B、C电负性大小顺序为C>A>B
【答案】D
【解析】
根据元素在周期表中的位置知,A、B、C、D、E分别是N、O、F、Cl、Si元素;
A.SiCl4分子中Si的化合价为+4价,Cl的化合价为-1价,Si原子最外层电子数为4,Cl原子最外层电子数为7,则各原子都达到了8电子稳定结构,故A正确;
B.NCl3和SiCl4两分子的中心原子价层电子对数都是4,所以均为sp3杂化,故B正确;
C.元素的非金属性越强,其气态氢化物越稳定,非金属性F>Cl,所以C、D气态氢化物稳定性强弱为C>D,故C正确;
D.元素非金属性越强电负性越强,同周期元素随着原子序数增大非金属性增强,所以电负性大小顺序为C>B>A,故D错误;
故选D。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下制得氯气的各个反应中,氯元素既被氧化又被还原的是
A.2KClO3+I2=2KIO3+Cl↓
B.Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O
C.4HCl+O2 ![]() 2Cl2+2H2O
2Cl2+2H2O
D.2NaCl+2H2O ![]() 2NaOH+H2↓+Cl2↑
2NaOH+H2↓+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48,下列说法不正确的是
X | Y | |
Z | W |
A.原子半径(r)大小比较:![]()
B.X和Y可形成共价化合物XY、![]() 等化合物
等化合物
C.Y的非金属性比Z的强,所以Y的最高价氧化物的水化物酸性大于Z
D.Z的最低价单核阴离子的失电子能力比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.![]() 属于有机物,因此是非电解质
属于有机物,因此是非电解质
B.石油裂化和裂解的目的均是为了将长链烃转化为短链烃
C.煤的气化,液化和干馏都是化学变化
D.等质量的乙烯,丙烯分别充分燃烧,所耗氧气的物质的量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的![]() 和
和![]() 固体的混合物溶于适量的水,将所得溶液等分成两份,向其中一份中缓慢逐滴加入某浓度的盐酸,产生的气体体积与所加盐酸体积之间的关系如图所示;向另一份中加入过量的
固体的混合物溶于适量的水,将所得溶液等分成两份,向其中一份中缓慢逐滴加入某浓度的盐酸,产生的气体体积与所加盐酸体积之间的关系如图所示;向另一份中加入过量的![]() 溶液,得到白色沉淀3.94g。试回答下列问题:
溶液,得到白色沉淀3.94g。试回答下列问题:

(1)盐酸的物质的量浓度为________________。
(2)固体混合物中![]() 的质量为________________。
的质量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷铁(含P、Fe、Cr等)是磷化工生产过程中产生的副产物,一种以磷铁为原料制备![]() 和
和![]() 的流程如图所示:
的流程如图所示:

已知:水浸后溶液的主要成分为![]() 和
和![]() ;
;![]() 的
的![]() 回答下列问题:
回答下列问题:
(1)“破碎”的目的为________________________________________________________。
(2)“焙烧”时,应将原料加到________坩埚中(填“陶瓷”或“钢制”),原因是_____________(结合化学方程式解释),Cr单质发生的主要反应的化学方程式为________。
(3)进一步提纯粗磷酸钠晶体的方法为________________。
(4)“酸化”时发生反应的离子方程式为________________________________________________。
(5)“沉铬”时,加NaOH调节至pH为________时,铬离子刚好沉淀完全。(已知:![]() ,离子浓度为10-5mol/L时可认为该离子沉淀完全)
,离子浓度为10-5mol/L时可认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示:
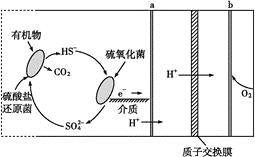
HS-在硫氧化菌作用下转化为SO![]() 的反应式是__。
的反应式是__。
(2)PbSO4热激活电池可用作火箭、导弹的工作电源,基本结构如图所示,其中作为电解质的无水LiCl—KCl受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
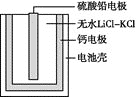
①放电过程中,Li+向__(填“负极”或“正极”)移动。
②负极反应式为__。
③电路中每转移0.2mol电子,理论上生成__gPb。
(3)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如图所示。
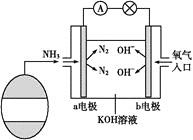
①a电极的电极反应式是__。
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )
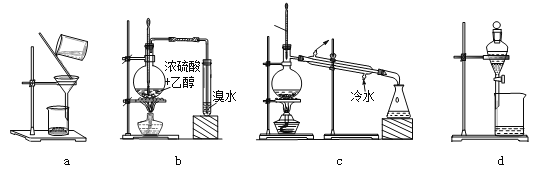
A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com