
【题目】已知可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A. 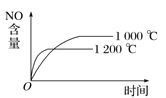 B.
B. 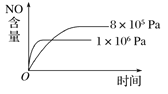
C. 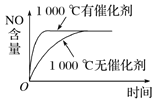 D.
D. 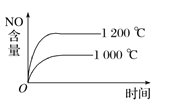
【答案】D
【解析】
A.该反应为放热反应,升高温度平衡逆向移动,反应速率加快;
B.该反应为气体体积增大的反应,增大压强平衡逆向移动,反应速率加快;
C.催化剂对平衡移动无影响,但加快反应速率;
D.该反应为放热反应,升高温度平衡逆向移动。
A. 该反应为放热反应,升高温度平衡逆向移动,反应速率加快,则温度高时NO的含量低,反应时间少,与图象一致,A项正确;
B. 该反应为气体体积增大的反应,增大压强平衡逆向移动,反应速率加快,则压强高时NO的含量低,反应时间少,与图象一致,B项正确;
C. 催化剂对平衡移动无影响,但加快反应速率,则NO的平衡含量相同,使用催化剂时时间少,与图象一致,C项正确;
D. 该反应为放热反应,升高温度平衡逆向移动,则温度高时NO的含量低,与图象不符,D项错误;
答案选D。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】(1)①标准状况下,1g氢气和14g氮气的体积相同
②常温常压下,16g氧气和臭氧的混合气体中含有的质子数为8NA
③0.1L 0.5mol/LCH3CH2OH溶液中含有氢原子数为0.3NA
④常温常压下,28gCO的体积大于22.4L
⑤分子总数相等的NO2和CO2,所含氧原子数均为2NA
上述表述中正确的有:_______
(2)用容量瓶配制溶液时,由于操作不当会引起误差
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
上述情况会使所配溶液浓度偏低的是 :_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g)![]() 2CO(g),能使反应速率加快的措施是( )
2CO(g),能使反应速率加快的措施是( )
①通过减小容器体积增大压强②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2.
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
A. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的![]()
C. 其他条件不变,将容器体积缩小至5 L,平衡正向移动,平衡常数增大
D. 以Y浓度变化表示的反应速率为0.000 5 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数为NA,下列说法正确的是( )
A.1mol钠与足量氧气反应,生成氧化钠和过氧化钠的混合物,转移的电子数为NA
B.通常状况下,NA个CO2分子的体积是22.4L
C.100ml0.1mol/L的H2SO4溶液中H+的个数是0.2NA
D.若1gN2含有m个分子,则NA=m/28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L的NaOH溶液450ml。根据这种溶液的配制情况回答下列问题:
(1)在如图所示仪器中,配制上述溶液肯定不需要的是___(填序号),除图中已有仪器外,配制上述溶液还需要到的玻璃仪器是___。
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)___。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于___、后用于___。
(4)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是___
A.①②③④ B.②③ C.①②④ D.②③④
(5)根据计算用托盘天平称取的质量为___g。
II.若配制1mol/L的稀硫酸溶液500mL。
(6)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为:___mL(计算结果保留一位小数)。如果实验室有15mL、20mL、50mL量筒,应选用__mL的量筒最好。
(7)下列操作所造成硫酸浓度偏高的是___。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视刻度线
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶中
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
(提出假设)
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
(查阅资料)无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
(物质成分探究)
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
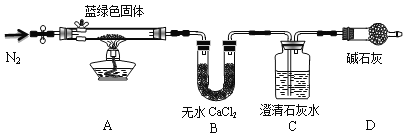
(1)假设2中的沉淀为________________。
(2)假设1中沉淀为Cu(OH)2的理论依据是____________________________________。
(3)无水乙醇洗涤的目的____________________________________________________。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设____(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用_____________________试剂后,便可验证上述所有假设,装置D的作用是__________________________。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_________________。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2溶液代替C中澄清石灰水,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com