
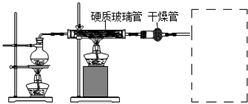
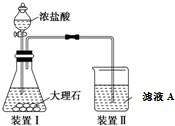
分析 实验目的是验证铁与水蒸气的反应,则圆底烧瓶用于制备水蒸气,在加热条件下铁与水蒸气反应生成四氧化三铁和氢气,因不纯氢气燃烧易爆炸,如果要在A处玻璃管处点燃该气体,必须验纯,检验所得固体中含有Fe3O4,可加酸溶解,用KSCN检验,如检验含有铁,可用硫酸铜溶液或盐酸检验,以此解答该题.
解答 解:(1)铁与水蒸气发生氧化还原反应,生成Fe3O4和H2,方程式为3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4+4H2,用固体干燥剂干燥氢气,可用碱石灰或氯化钙,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4+4H2;碱石灰(氯化钙);
(2)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气;加热液体时要防止暴沸,故应加入少量碎瓷片防止暴沸发生,
故答案为:提供水蒸气;防止暴沸;
(3)铁和水蒸气反应生成氢气,必须验纯,否则不纯氢气燃烧易爆炸,氢气密度比空气小,可用向下排空法收集,如图 ,
,
故答案为:H2;验纯; ;
;
(4)检验所得固体中含有Fe3O4,可加酸溶解,用KSCN检验,现象是溶液显血红色,如检验含有铁,可用硫酸铜溶液或盐酸检验,加入足量CuSO4溶液,若有红色固体生成,说明固体中含有Fe,或取少量固体,加入足量稀HCl溶液,若有无色气泡生成,说明固体中含有Fe,
故答案为:取少量固体溶解在盐酸中,滴加少量KSCN溶液,若溶液显血红色,说明固体中含有Fe3O4;?取少量固体,加入足量CuSO4溶液,若有红色固体生成,说明固体中含有Fe,或取少量固体,加入足量稀HCl溶液,若有无色气泡生成,说明固体中含有Fe.
点评 本题考查了物质的制备、物质成分的探究实验,题目侧重于考查学生的实验探究能力,注意把握铁及其化合物的性质以及铁离子的检验方法,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
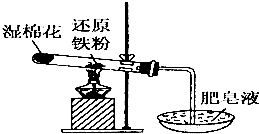 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
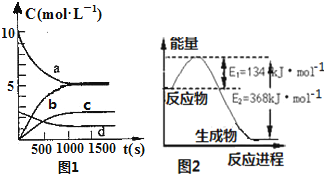 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com