
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题。

(1)④、⑤、⑦的原子半径由大到小的顺序为______________(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>__________
(3)④、⑥、⑦的气态氢化物的稳定性由弱到强的顺序是_______________。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式_______________________。
【知识点】元素周期表和元素周期律E2
【答案解析】(1)Na >Cl>F (2)HClO4(1分) H2SO4(1分)
(3)H2S<HCl<HF (4)H2O2+2Fe2++2H+=2Fe3++2H2O
解析:根据元素在周期表内的位置①②③④⑤⑥⑦分别对应的元素是:H、O、Al、F、Na、S、Cl;
(1)根据同周期左到右元素的原子半径减小,同主族上到下元素的原子半径增大,④、⑤、⑦的原子半径由大到小的顺序为Na >Cl>F。
(2)非金属性S<Cl,最高价含氧酸的酸性强弱为:HClO4> H2SO4
(3)根据元素非金属性越强,气态氢化物越稳定,元素非金属性S<Cl<F,气态氢化物的稳定性由弱到强的顺序是H2S<HCl<HF。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物H2O2,在酸性溶液中能将Fe2+氧化,反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O
【思路点拨】本题考查了元素周期表和元素周期律,首先确定元素名称再利用元素周期律分析解答。


科目:高中化学 来源: 题型:
第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。其电路工作原理如图所示。下列说法中正确的的是( )
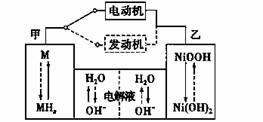
A.电池充电时,OH-由甲侧向乙侧移动
B.甲放电时为正极,充电时为阳极
C.放电时负极的电极反应式为MHn-ne- = M+nH+
D.汽车下坡时发生图中实线所示的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
口香糖中常用木糖醇作甜味剂,木糖醇可以防止龋齿,木糖醇的结构简式为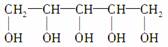 ,下列有关木糖醇的说法中,正确的是( )
,下列有关木糖醇的说法中,正确的是( )
A.木糖醇是一种单糖,不能发生水解反应
B.木糖醇易溶解于水,能发生酯化反应
C.木糖醇在口腔中易被氧化为酸
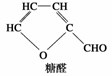
D.木糖醇脱去三分子水可得糠醛(结构如右图)
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
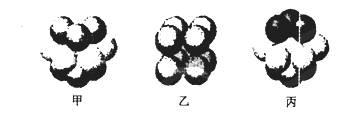
查看答案和解析>>
科目:高中化学 来源: 题型:
.锗(Ge)、锡(Sn)、铅(Pb)与碳、硅两元素同位于第ⅣA族,其原子序数按锗、锡、铅的顺序依次增大,则下列推断一定不正确的是
A.锗、锡在空气中不反应,铅在空气中表面生成一层氧化铅
B.锗与盐酸不反应,锡、铅能与盐酸反应
C.锗、锡、铅的+4价氢氧化物的碱性:Ge(OH)4<Sn(OH)4<Pb(OH)4
D.锗、锡、铅的金属性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
C、N、O、Na、Al、S、Cl是常见的元素
(1)C元素位于元素周期表的位置 ;C元素的一种同位素可以测定文物年代,这种同位素的符号为 。
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)黑火药爆炸时发生反应的化学方程式为:S+2KNO3 +3C==K2S +3CO2↑+N2↑反应生成物中,属于非电解质的是_______(写结构式);其中熔点最高的物质的电子式是_________。
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化合物有不同的分类方法,下列说法正确的是( )
①从组成元素分:烃,烃的衍生物 ②从分子中碳骨架形状分:链状有机化合物,环状有机化合物 ③从官能团分:烯烃、炔烃、芳香烃、卤代烃、醇、酚、醛、酮、羧酸、酯等
A.①③ B.①② C.①②③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离平衡曲线如图所示:
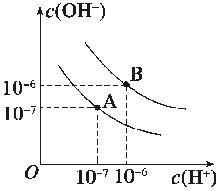
(1)若以A点表示25℃时水电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从______增加到________。
(2)将pH=8的氢氧化钡溶液与pH=5的盐酸溶液混合并保持100℃恒温,欲使混合溶液的pH=7,则氢氧化钡溶液与盐酸的体积比为________。
(3)已知AnBm的离子积K=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)和c(Bn-)表示离子的物质的量浓度。在某温度下,氢氧化钙溶解度为0.74 g,其饱和溶液密度设为1 g/cm3,其离子积为K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com