
| A.元素X能形成化学式为X(OH)3的碱 |
| B.元素X可能形成化学式为KXO3的含氧酸钾盐 |
| C.元素X原子的最外层电子数和核电荷数肯定为奇数 |
| D.元素X能与某些金属元素形成化合物 |
科目:高中化学 来源:不详 题型:填空题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | –1 | –2 | +4、–4 | +4、–2 | +5、–3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
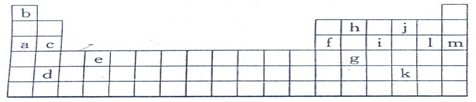
| | 锂 | X | Y |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | | 9 550 | 11 600 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | | | | | | | |
| 2 | | | | | ② | ③ | | ④ |
| 3 | ⑤ | ⑥ | ⑦ | | | ⑧ | ⑨ | |
| 4 | ⑩ | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | C | N | O | | Ne |
| 3 | Na | Mg | Al | Si | | S | Cl | m] |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子核外最外层电子数随原子序数的增大而增多 |
| B.气态氢化物的稳定性随原子序数的增大而增强 |
| C.原子半径随原子序数的增大而减小 |
| D.氯水、溴水和碘水均能使淀粉碘化钾试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | x | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2 反应情况 | 点燃时 易化合 | 加热化合 | 加热难 化合 | 不能直 接化合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com