
| A、④⑤ | B、①④ | C、②③ | D、③⑤ |


科目:高中化学 来源: 题型:
| A、1.0 mol/L的Fe(NO3)2溶液:H+、Na+、SCN-、S2- |
| B、c(OH-)/c(H+)=1013的溶液Mg2+、NH4+、MnO4-、Cl- |
| C、pH=l的溶液:K+、NH4+、NO3-、Cl- |
| D、能溶解Al2O3的溶液:Na+、K+、HCO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HCN |
| pH | 3.4 | 5.6 |
| A、相同pH的两种酸溶液中,CH3COOH溶液中水电离的试c(H+)浓度较大 |
| B、物质的量浓度相同的CH3COONa与NaCN溶液中,CH3COONa溶液pH较大 |
| C、等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH |
| D、HCN的电离平衡常数(Ka)与CN-的水解平衡常数(K)存在如下关系:Ka?K=KW |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据如图可以写出热化学方程式As2O5(s)=As2O3(s)+O2( g)△H=a kJ/mol.则a为( )
根据如图可以写出热化学方程式As2O5(s)=As2O3(s)+O2( g)△H=a kJ/mol.则a为( )| A、+1533.8 |
| B、-1533.8 |
| C、+295.4 |
| D、-295.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
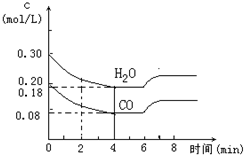
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在澄清石灰水中通入过量CO2:CO2+2OH-=CO32-+H2O | ||||
B、用惰性电极电解Cu(NO3)2溶液:Cu2++2OH-
| ||||
| C、将足量Cl2通入到FeI2溶液中:3Cl2+2Fe2++4I-=2I2+6Cl-+2Fe3+ | ||||
| D、金属Al溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
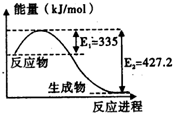 (1)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe |
| B、Li-Al合金在电池中作为负极材料 |
| C、负极的电极反应式为Al-3e-=Al3+ |
| D、充电时,阳极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,分子数为NA的C0、C2H4.混合气体体积约为22.4L,质量为28g |
| B、25℃时,pH=2的1.OL H2SO4溶液中含有的H+数目为0.2NA |
| C、4.6g Na在空气中完全反应生成Na2O Na2O2混合物,转移电子数目为0.2NA |
| D、1mol金刚石和晶体桂的混合物中,含有共价键数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com