
�����ᣨH3PO2����һ�־�ϸ������Ʒ�����н�ǿ��ԭ�ԣ��ش��������⣺
��1��H3PO2��һԪ��ǿ�ᣬд������뷽��ʽ������
��2��H3PO2��NaH2PO2���ɽ���Һ�е������ӻ�ԭΪ�����ʣ��Ӷ������ڻ�ѧ������
��H3PO2�У���Ԫ�صĻ��ϼ�Ϊ����
������H3PO2���л�ѧ������Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ4��1������������Ϊ���������ѧʽ��
��NaH2PO2�����λ�����ʽ�Σ�����
��3��H3PO2�Ĺ�ҵ�Ʒ��ǣ������ף�P4��������������Һ��Ӧ����PH3�����Ba��H2PO2��2�������������ᷴӦ��д������������������Һ��Ӧ�Ļ�ѧ����ʽ��������
| ���������ˮ��Һ�еĵ���ƽ�⣮. | |
| ר�⣺ | ����ƽ������Һ��pHר�⣮ |
| ������ | ��1������H3PO2��һԪ��ǿ���֪��H3PO2��������ʣ���Һ�в��ֵ���������ӣ��ݴ�д�����뷽��ʽ�� ��2���ٸ��ݻ��������ܻ��ϼ�Ϊ0�����PԪ�صĻ��ϼۣ� �����ж�����������������Ȼ������������뻹ԭ�������ʵ���֮��Ϊ4��1�������Ӧ������P�Ļ��ϼۣ� �۸���H3PO2��һԪ��ǿ�ᣬ�����ж�NaH2PO2Ϊ���Σ� ��3�����ݷ�Ӧ�����������ԭ���غ�͵����غ���д����ʽ�� |
| ��� | �⣺��1��H3PO2��һԪ��ǿ�ᣬ��Һ�в��ֵ���������ӣ���������뷽��ʽΪH3PO2⇌H2PO2��+H+���ʴ�Ϊ��H3PO2⇌H2PO2��+H+�� ��2����H3PO2�У��ܻ��ϼ�Ϊ0��������Ԫ��Ϊ+1�ۣ���Ԫ��Ϊ��2�ۣ���PԪ�صĻ��ϼ�Ϊ+1�ۣ��ʴ�Ϊ��+1�� �ڸ÷�Ӧ��Ag+Ϊ��������H3PO2Ϊ��ԭ�����������뻹ԭ�������ʵ���֮��Ϊ4��1���跴Ӧ������P�Ļ��ϼ�Ϊx�����ݻ��ϼ�������ȿɵã�4����1��0��=1����x��1�������x=5��������������Ϊ+5�۵�H3PO4�� �ʴ�Ϊ��H3PO4�� ������H3PO2��һԪ��ǿ�ᣬ����NaH2PO2Ϊ���Σ��ʴ�Ϊ�����Σ� ��3�����ף�P4����Ba��OH��2��Һ��Ӧ����PH3�����Ba��H2PO2��2����Ӧ����ʽΪ2P4+3Ba��OH��2+6H2O=3Ba��H2PO2��2+2PH3���� �ʴ�Ϊ��2P4+3Ba��OH��2+6H2O=3Ba��H2PO2��2+2PH3���� |
| ������ | ���⿼�����ε�ˮ��ԭ����������ʵĵ��롢������ԭ��Ӧ��֪ʶ����Ŀ�Ѷ��еȣ������漰��֪ʶ��϶࣬��ֿ�����ѧ������ѧ֪ʶ����������� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
X��Y��Z�����ֶ����ڽ���Ԫ�أ�ԭ���������������ʵ����ʵ����ֱ�Ϊn(X)��n(Y)��n(Z)���������������ᷴӦ�������������(��״����)ΪV(H2)X��V(H2)Y��V(H2)Z����n( X)��n(Y)��n(Z)��2V(H2)X��V(H2)Y��V(H2)Z������˵����ȷ����(����)
X)��n(Y)��n(Z)��2V(H2)X��V(H2)Y��V(H2)Z������˵����ȷ����(����)
A��X��Y��Zһ������ͬһ����
B��X������þ
C��Y��Z������������Ӧ��ˮ������һ���������ܷ�Ӧ
D����ҵ��ұ��X��Y��Zͨ�������Ȼ�ԭ���Ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�� �Ϲ�����仯�����2009��12��7��18���ڸ籾�����ٿ����й�������ŵ��2020�꣬��λGDP������̼�ŷű�2005���½�40%��45%��
�Ϲ�����仯�����2009��12��7��18���ڸ籾�����ٿ����й�������ŵ��2020�꣬��λGDP������̼�ŷű�2005���½�40%��45%��
(1)��Ч����̼�����ֶ�֮һ�ǽ��ܡ��������ⷽ������ܵ���________(����ĸ���)��
A�����ˮ���⣺2H2O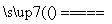 2H2����O2��
2H2����O2��
B������ʹˮ�ֽ����⣺2H2O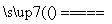 2H2����O2��
2H2����O2��
C��̫������ֽ�ˮ���⣺2H2O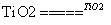 2H2����O2��
2H2����O2��
D����Ȼ�����⣺CH4��H2O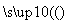 CO��3H2
CO��3H2
(2)��CO2�������ϳ�CH3OCH3(����)�ǽ����ԴΣ�����о�����֮һ��
��֪��CO(g)��2H2(g)  CH3OH(g)����H����90.7kJ·mol��1
CH3OH(g)����H����90.7kJ·mol��1
2CH3OH(g)  CH3OCH3(g)��H2O(g)����H����23.5kJ·mol��1
CH3OCH3(g)��H2O(g)����H����23.5kJ·mol��1
CO(g)��H2O(g)  CO2(g)��H2(g)����H����41.2kJ·mol��1
CO2(g)��H2(g)����H����41.2kJ·mol��1
��CO2�������ϳ�CH3OCH3(g)���Ȼ�ѧ����ʽΪ_____ ______________________________
______________________________
______________________________________________________________________��
(3)�ڴ�����һ���¶ȡ�ѹǿ�����£�CO��H2�ɷ�Ӧ���ɼ״���CO(g)��2H2(g)  CH3OH(g)��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����p1________p2(�<������>����
CH3OH(g)��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����p1________p2(�<������>���� ����)��������Ӧ�Ħ�H________0(�<������>������)��
����)��������Ӧ�Ħ�H________0(�<������>������)��
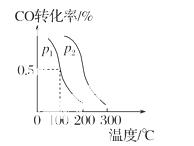
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2005��1��������ѧ���ڡ�Science���Ϸ������ģ��������������ġ�����ԭ�ӡ��ṹ��Al13��Al14����֪���ࡰ����ԭ�ӡ�����������֮��Ϊ40��ʱ��������ȶ�״̬������˵���У���ȷ���ǣ�������
| �� | A�� | Al13��Al14��Ϊͬλ�� |
| �� | B�� | Al13��ԭ����Alԭ�Ӽ�ͨ�����Ӽ���� |
| �� | C�� | Al14����������֮��Ϊ42����ڢ�A��Ԫ�ص��������� |
| �� | D�� | Al13��Al14�����н�ǿ�Ļ�ԭ�ԣ�����ʧȥ�������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��B��C��X��Ϊ��ѧ���������ʣ�һ�����������ǵ�ת����ϵ���£�����������ȥ����A 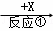 B
B 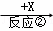 C
C
�Իش�
��1����XΪO2����A����������������ѡ���
a��Si b��NH3 c��Mg d��S
��2����A��B��C��ˮ��Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��XΪCO2�������ӷ���ʽ����B��Һ�Լ��Ե�ԭ���������ٳ�C��һ����;������
��3����A��һ�ֻ���ɫ���嵥�ʣ�X��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬��Ӧ�������û���Ӧ��д����Ӧ�ٵĻ�ѧ����ʽ������C��ˮ��Һ�и�����Ũ���ɴ�С˳��Ϊ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ʵ��װ�ý�����Ӧʵ�飬װ����ȷ���ܴﵽʵ��Ŀ�ĵ���
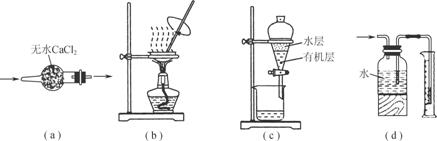
A����ͼa��ʾװ�ø���SO2����
B����ͼb��ʾװ������CH3COONa��Һ�ô����ƾ���
C����ͼc��ʾװ�÷����л�����ˮ�㣬ˮ��ӷ�Һ©���¿ڷų�
D����ͼd��ʾװ�ò������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ҹ�������Ա����Ҷ����Ϊԭ�����Ƶû��������ת��Ϊ���п����־����Եı����ƻ�������й�ת����ͼ��ʾ�������й�˵������ȷ����
A�����������ʹ����KMnO4��Һ��ɫ
B�������������к���4������̼ԭ��
C���������һ���������ܷ���ȡ������ȥ��
�ӳɷ�Ӧ
D�����黯������Ƿ���������Br2��
CCl4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ��д��ȷ���ǣ� ��
A��NH4HSO3��Һ�������NaOH��Һ��ϣ�NH4����OH- ==��NH3��H2O
B��Na2SO3��Һʹ����KMnO4��Һ��ɫ��5SO32- + 6H+ + 2MnO4- == 5SO42- + 2Mn2+ +3H2O
C����Na2CO3��Һ�м������CH3COOH��Һ CO32����2H+== CO2����H2O
D��Fe(NO3)3��Һ�м��������HI��Һ��2Fe3��+2I�� = 2Fe2��+I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ʵ���������ʼ�ֱ��ת����Ԫ����(����)
����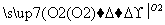 ������
������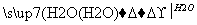 ����
����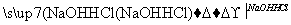 ��
��
A���� B����
C��ͭ D����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com