

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
分析 通过氮气将装置中空气排出,防止TiCl4被氧化,A为干燥管,干燥氮气,防止生成的TiCl4遇潮湿的气体产生白雾;B装置加热使四氯化碳挥发,C中装置在加热条件下,发生反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,D装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,E装置连接空气,盛放浓硫酸,干燥空气.
(1)根据仪器的特征及常见仪器的名称解答;
(2)反应得到气体TiCl4与二氧化碳,装置气密性要好,在加装药品之前应检验装置的气密性,互溶的液体需根据沸点不同进行蒸馏 (或分馏)分离;
(3)由于TiCl4遇潮湿空气产生白雾,发生水解反应,且反应在无氧条件下进行,故E装置作用是防止空气中水蒸气、氧气进入;A装置不能吸收空气中的氧气;
(4)根据钛是一种耐强酸强碱的金属,而硅能溶于碱生成硅酸盐,硅酸盐和酸生成硅酸沉淀,据此分析设计检验实验方案;
(5)根据反应物和生成物结合质量守恒定律来书写化学方程式;
(6)①铁离子易水解,配制溶液时先加一些硫酸,使溶液呈酸性,抑制NH4Fe(SO4)2水解;
②用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3;
③根据转移电子数相等计算二氧化钛的质量,再根据质量分数公式进行计算.
解答 解:通过氮气将装置中空气排出,防止TiCl4被氧化,A为干燥管,干燥氮气,防止生成的TiCl4遇潮湿的气体产生白雾;B装置加热使四氯化碳挥发,C中装置在加热条件下,发生反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,D装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,E装置连接空气,盛放浓硫酸,干燥空气.
(1)仪器A呈球形,在该实验中用于干燥氮气,为球形干燥管,
故答案为:球形干燥管;
(2)反应得到气体TiCl4与二氧化碳,装置气密性要好,在加装药品之前应检验装置的气密性,CCl4、TiCl4熔点较低,D装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏 (或分馏)方法分离,
故答案为:检验装置气密性;蒸馏 (或分馏);
(3)由于TiCl4遇潮湿空气产生白雾,发生水解反应,且反应在无氧条件下进行,故E装置作用是防止空气中水蒸气、氧气进入;A装置可以吸收水,但不能不能吸收空气中的氧气,不能保证反应在无氧环境下进,故E装置不能换成A装置;
故答案为:不能;装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行;
(4)钛是一种耐强酸强碱的金属,而硅能溶于碱生成硅酸盐,取少量合金样品于试管中,滴加过量NaOH溶液,振荡,Si+2NaOH+H2O=Na2SiO3+2H2↑,静置后取上层清液,再逐滴滴入稀盐酸至过量,Na2SiO3+2HCl=H2SiO3↓+2NaCl,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si,
故答案为:取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si;
(5)TiCl4水解生成TiO2•xH2O,设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(x+2),所以化学方程式为:TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl,
故答案为:TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl;
(6)①铁离子易水解,配制溶液时先加一些硫酸,使溶液呈酸性,抑制NH4Fe(SO4)2水解,
故答案为:抑制NH4Fe(SO4)2水解;
②因为KSCN作指示剂时,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3,所以用KSCN作指示剂,
故答案为:KSCN溶液;
③根据氧化还原反应中得失电子相等得二者的关系式,TiO2~NH4Fe(SO4)2,二氧化钛的质量=$\frac{0.1mol/L×0.02L×1}{1}$g/mol=0.16g,TiO2试样0.2g,其质量分数=$\frac{0.16g}{0.2g}$=80%,
故答案为:80%.
点评 本题考查实验制备方案以及测定TiO2的质量分数实验方案,明确原理是解题关键,侧重考查学生装置的分析评价,注意对题目信息的提取与应用,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
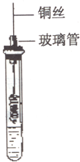 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
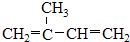 ⑤ClCH=CHCl ⑥
⑤ClCH=CHCl ⑥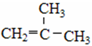 ⑦
⑦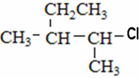 ⑧
⑧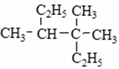 ⑨
⑨
 .
.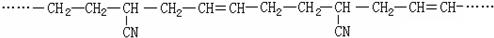
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒化氢的稳定性比水的弱 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 硒的氧化性比硫的强 | |
| D. | 硒的最高价氧化物对应的水化物酸性比砷的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
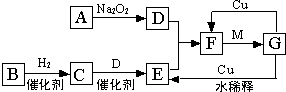 如图是由短周期元素组成的一些单质及其化合物之间的转化关系图(部分产物和反应条件已略去),其中A、B、D在常温下均为无色、无刺激性气味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图是由短周期元素组成的一些单质及其化合物之间的转化关系图(部分产物和反应条件已略去),其中A、B、D在常温下均为无色、无刺激性气味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
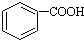 >H2CO3>
>H2CO3>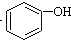 ,将
,将 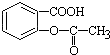 转变为
转变为 的方法是( )
的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| C. | 加热溶液,通入足量的CO2 | |
| D. | 与稀H2SO4共热后,加入足量的NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤代烃在NaOH的醇溶液中共热均能发生消去反应生成烯烃 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 能与FeCl3溶液作用显紫色的有机物一般含有酚羟基 | |
| D. | 酯类水解均能生成含相同碳原子数的羧酸和醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com