
| A. | 反应前盐酸的温度 | B. | 反应前盐酸的质量 | ||
| C. | 反应前氢氧化钠溶液的温度 | D. | 反应前氢氧化钠溶液的质量 | ||
| E. | 反应后混合溶液的最高温度 | F. | 反应后混合溶液的质量 |
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成:
)是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成:
 .
. .
. (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

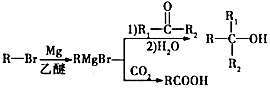
 ,其反应类型为取代反应.
,其反应类型为取代反应. .
. (写结构简式).
(写结构简式).
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com