
| A、32g甲醇中含有C-H键的数目为4NA |
| B、1L 0.1mol?L-1的氨水含有0.1NA个OH- |
| C、10L pH=1的硫酸溶液中含有的H+数为2NA |
| D、H2S和SO2气体混合生成0.3mol单质硫时,转移电子的数目为0.4NA |


科目:高中化学 来源: 题型:
| 选项 | 离子方程式 | 评价 |
| A | 将2mol Cl2通入到含1mol FeI2的溶液中: 2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
| B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO3-+OH-=MgCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性: H2SO3强于HClO |
| D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L的NaOH溶液中Na+的物质的量为1mol |
| B、28g乙烯所含共用电子对数目为4NA |
| C、常温常压下,32g O2与O3的混合气体中含有的原子总数为2NA |
| D、1mol苯中含有碳碳双键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用碳酸钠溶液处理水垢中的硫酸钙:Ca2++CO32-=CaCO3↓ | ||||
| B、SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- | ||||
| C、用石墨电极电解AlCl3溶液,阴极附近生成沉淀:2Al3++6H2O+6e-=2Al(OH)3↓+3H2↑ | ||||
D、工业上制取硅:SiO2+C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
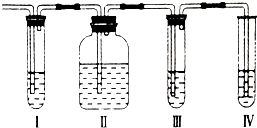 在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题:
在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题:| 光照 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为:
(1)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com