
NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,其充分的理由是( )
A.NH3分子是极性分子
B.分子内3个N—H键的键长相等,键角相等
C.NH3分子内3个N—H键的键长相等,3个键角都等于107.3°
D.NH3分子内3个N—H键的键长相等,3个键角都等于120°
科目:高中化学 来源: 题型:
如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是( )
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示AlO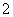 的物质的量的变化
的物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
我国已经成功研制出了碱金属的球碳盐K3C60。实验测知该物质在熔融状态下可以导电,而且在超临界温度18 K时具有超导性。
(1)K3C60含有化学键的类型为__________________(填“极性键”、“非极性键”或“离子键”)。
(2)1 mol K3C60含有的离子数目为________。
(3)K3C60中的C60俗称足球烯,分子结构酷似足球,由12个正五边形与20个正六边形构成,碳碳键长介于碳碳单键与碳碳双键之间,则其中碳的杂化方式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的熔、沸点高低只与范德华力有关的是( )
A.Li、Na、K、Rb
B.HF、HCl、HBr、HI
C.LiCl、NaCl、KCl、RbCl
D.F2、Cl2、Br2、I2
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,相同物质的量浓度的下列溶液:①NaCl
②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是( )
A.④>③>②>① B.②>③>①>④
C.④>①>②>③ D.③>②>①>④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下,向20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
(1)a点溶液中c(H+)为________,pH约为________。
(2)a、b、c、d四点中水的电离程度最大的是__________,滴定过程中宜选用____________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


查看答案和解析>>
科目:高中化学 来源: 题型:
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g)
ΔH=+140.5 kJ·mol-1
C(s,石墨)+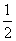 O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是 ( )。
A.+80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.-80.5 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com