
| A. | 单质钠放入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 二氧化硅溶于NaOH溶液:SiO2+2OH-═SiO32-+H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
分析 A.原子个数不守恒;
B.二氧化硅与氢氧化钠反应生成硅酸钠和水;
C.不符合反应客观事实;
D.氢氧化钠过量碳酸根离子、铵根离子都反应;
解答 解:A.单质钠放入水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.二氧化硅溶于NaOH溶液,离子方程式:SiO2+2OH-═SiO32-+H2O,故B正确;
C.向氯化铝溶液中加入过量氨水,二者反应生成氢氧化铝,氢氧化铝不溶于氨水,离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C错误;
D.NH4HCO3溶液与足量NaOH溶液混合加热的离子反应为NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+CO32-+2H2O,故D错误;
故选:B.
点评 本题考查离子方程式的书写,明确发生的化学反应为解答的关键,为高考常见题型,注意把握量对反应的影响,注重基础知识的考查,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{W}{A+16}$(A-N+8)mol | B. | $\frac{W}{A+16}$(A-N+10)mol | C. | (A-N+8)mol | D. | $\frac{W}{A}$(A-N+6)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>C>B | |
| B. | B的氢化物比C的氢化物更稳定 | |
| C. | C与D可形成化合物D2C2,1mol该物质与水完全反应转移的电子数为NA | |
| D. | 由A、B、C形成的化合物一定只有共价键没有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A2)=0.8 mol•L-1•s-1 | B. | v(A2)=30 mol•L-1•min-1 | ||
| C. | v(AB3)=1.0 mol•L-1•s-1 | D. | v(B2)=1.2 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | 离子半径:Z>Y>X>W | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z的气态氢化物中,Z的熔点最高 | |
| D. | X元素的一种氢化物含极性键和非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Z>Y | |
| B. | X与W能形成共价化合物 | |
| C. | Y与Z组成的化合物溶于水呈酸性 | |
| D. | 元素X、Y、W的最高化合价均与其族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
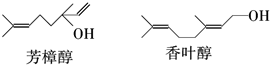
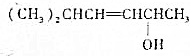 的键线式结构为
的键线式结构为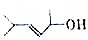 下列说法不正确的是( )
下列说法不正确的是( )| A. | 两种醇都能与溴水反应 | |
| B. | 两种醇互为同分异构体 | |
| C. | 两种醇与氧气在铜催化的条件下,均可被氧化为相应的醛 | |
| D. | 两种醇在浓H2S04存在下加热,均可与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②
② ③(CH3)3CCH2Cl ④CHCl-CHBr2⑤
③(CH3)3CCH2Cl ④CHCl-CHBr2⑤ ⑥CH3Cl.
⑥CH3Cl.| A. | ②③⑤ | B. | ①③⑥ | C. | 全部 | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com