
����Ŀ����ѧ�һ���̽���¼�����CO2�����ۺ����á�
��CO2�������ϳɵ�̼ϩ����2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ��H=akJ/mol
CH2=CH2(g)+4H2O(g) ��H=akJ/mol
��ش�
��1����֪��H2��CH2=CH��ȼ���ȷֱ���285.8kJ/mol��1411.0kJ/mol����H2O(g)![]() H2O(��1����H=-44.0kJ/mol����a=________kJ/mol��
H2O(��1����H=-44.0kJ/mol����a=________kJ/mol��
��2��������CO2�ϳ�CH2=CH2�ķ�Ӧ��________���Է�����(����¡����¡�)��
��3�������Ϊ1L�ĺ����ܱ������У�����3molH2��1molCO2������¶ȶ�CO2��ƽ��ת���ʺʹ�����Ч�ʵ�Ӱ����ͼ1��ʾ������˵����ȷ����________��
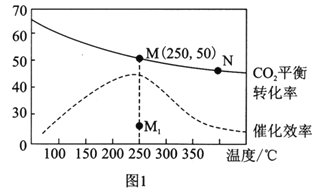
A��ƽ�ⳣ����С��KMN
B��������������,����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ�ڵ�M1
C��ͼ1��M��ʱ,��ϩ���������Ϊ7.7%
D����ѹǿ��n(H2)/n(CO2)����ʱ����֤����ѧ��Ӧ�Ѵﵽƽ��״̬
��4�������¶Ȳ���,�����ΪV L�ĺ�����������n(H2)��n(CO2)=3��1��Ͷ�ϱȼ��뷴Ӧ��,t0ʱ�ﵽ��ѧƽ�⡣����ͼ2�����������ڻ�������ƽ����Է�������![]() ��ʱ��仯��ͼ��___________
��ʱ��仯��ͼ��___________
�����á�Na-CO2����ؽ�CO2���Ϊ�����ҹ�������Ա���Ƴ��Ŀɳ�硰Na-CO2�����,���Ʋ��Ͷ��̼����(MWCNT)Ϊ�缫����,�ܷ�ӦΪ4Na+3CO2![]() 2Na2CO3+C���ŵ�ʱ�õ�ء����롱CO2,�乤��ԭ����ͼ3��ʾ��
2Na2CO3+C���ŵ�ʱ�õ�ء����롱CO2,�乤��ԭ����ͼ3��ʾ��
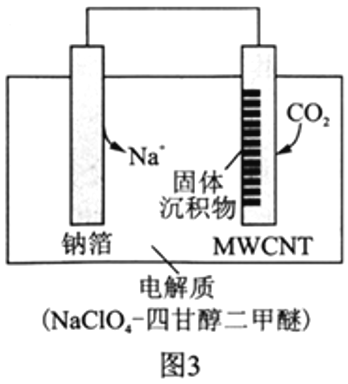
��5���ŵ�ʱ,�����ĵ缫��ӦʽΪ__________________��
��6�������ɵ�Na2CO3��Cȫ���������������棬��ת��0.2mole-ʱ���������ӵ�����Ϊ_______g��
��7��ѡ�ø��������ĸʴ������������Һ���ŵ���_____________________��
���𰸡� -127.8 ���� C  ����ͼҪ��O������(0,12.5)��t0ƽ��ʱ
����ͼҪ��O������(0,12.5)��t0ƽ��ʱ![]() ��12.5��20֮�䡣�� 3CO2+4Na++4e-=2Na2CO3+C 11.2 �����Ժá�������Ʋ���Ӧ���ѻӷ����ص�
��12.5��20֮�䡣�� 3CO2+4Na++4e-=2Na2CO3+C 11.2 �����Ժá�������Ʋ���Ӧ���ѻӷ����ص�
��������I.(1). �� H2(g)+1/2O2(g)=H2O(l) ��H=285.8kJ/mol��
�� C2H4(g)+3O2(g)=2H2O(l)+2CO2(g) ��H=1411.0kJ/mol��
�� H2O(g)�TH2O(l) ��H=44kJ/mol
���ݸ�˹���ɣ�6���٢�4���۵�2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ��H=6��(285.8kJ/mol)(1411.0kJ/mol)4��(44kJ/mol)= 127.8kJ/mol���ʴ�Ϊ��127.8��
CH2=CH2(g)+4H2O(g) ��H=6��(285.8kJ/mol)(1411.0kJ/mol)4��(44kJ/mol)= 127.8kJ/mol���ʴ�Ϊ��127.8��
(2). �������������Ȼ�ѧ����ʽ��֪����H<0������Ϊ���ȷ�Ӧ��2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)��Ӧǰ�����������С���ر��S<0��Ҫ�����HT��S<0��Ӧ�ڵ��������Է����У��ʴ�Ϊ�����£�
CH2=CH2(g)+4H2O(g)��Ӧǰ�����������С���ر��S<0��Ҫ�����HT��S<0��Ӧ�ڵ��������Է����У��ʴ�Ϊ�����£�
(3). A. �����¶ȶ�����̼��ƽ��ת���ʽ��ͣ�������ƽ�������ƶ�������M�㻯ѧƽ�ⳣ������N�㣬��A����B. ��������ʹƽ�ⷢ���ƶ�����ͼ���֪�������������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת����λ�ڵ�M����B����C. �����Ϊ1L�ĺ����ܱ������У�����3mollH2��1molCO2��ͼ��M��ʱ������̼ת����Ϊ50%��
6H2(g)+2CO2(g) ![]() CH2=CH2 (g)+4H2O(g)
CH2=CH2 (g)+4H2O(g)
��ʼ��(mol) 3 1 0 0
�仯��(mol) 1.5 0.5 0.25 1
ƽ����(mol) 1.5 0.5 0.25 1
����CH2=CH2���������=![]() ��100%=7.7%����C��ȷ��D���ɷ���ʽ��֪����ѹǿ����ʱ��˵����Ӧ�ﵽ��ƽ��״̬����H2��CO2����ʼ���������ڻ�ѧ������֮�ȣ���Ӧ������n( H2)/n(CO2 )ʼ�ղ���������n( H2)/n(CO2 )���䲻��֤����ѧ��Ӧ�Ѵﵽƽ��״̬����D����ѡC��
��100%=7.7%����C��ȷ��D���ɷ���ʽ��֪����ѹǿ����ʱ��˵����Ӧ�ﵽ��ƽ��״̬����H2��CO2����ʼ���������ڻ�ѧ������֮�ȣ���Ӧ������n( H2)/n(CO2 )ʼ�ղ���������n( H2)/n(CO2 )���䲻��֤����ѧ��Ӧ�Ѵﵽƽ��״̬����D����ѡC��
(4).��Ӧǰ��������ƽ����Է�������=![]() =12.5�������������Ϊ(0��12.5)�����ŷ�Ӧ��������������ʵ�����С����������ƽ����Է���������������t0ʱ�ﵽ��ѧƽ������ȫ��ת��ΪCH2=CH2��H2Oƽ����Է�������=
=12.5�������������Ϊ(0��12.5)�����ŷ�Ӧ��������������ʵ�����С����������ƽ����Է���������������t0ʱ�ﵽ��ѧƽ������ȫ��ת��ΪCH2=CH2��H2Oƽ����Է�������=![]() =20����t0��ƽ��ʱ
=20����t0��ƽ��ʱ![]() Ӧ������12.5��20֮��������ͼ��Ϊ
Ӧ������12.5��20֮��������ͼ��Ϊ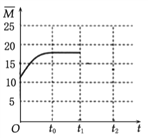 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
II. (5).�������ϣ�CO2�õ��ӷ�����ԭ��Ӧ���ʵ缫����ʽΪ3CO2+4Na++4e-=2Na2CO3+C���ʴ�Ϊ��3CO2+4Na++4e-=2Na2CO3+C��
(6).�����������ĵ缫��Ӧ��3CO2+4Na++4e-=2Na2CO3+C
3 4 2 1
0.15 0.2 0.1 0.05
m(��)=m(Na2CO3)+m(C)=106g/mol��0.1mol+12g/mol��0.05mol=11.2g���ʴ�Ϊ��11.2��
(7).ѡ���{�������ĸʴ������������Һ���ŵ��ǵ����Ժã�������Ʋ���Ӧ���ѻӷ��ȣ��ʴ�Ϊ�������Ժá�������Ʋ���Ӧ���ѻӷ����е���


 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��ת����ͨ��һ����Ӧ����ʵ�ֵ��ǣ� ��
A.CO2��Na2CO3
B.FeCl3��FeCl2
C.H2SiO3��Na2SiO3
D.S��SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��е���������Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش��������⣺
���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� | �� |
��1����������Ԫ���У�ԭ�Ӱ뾶������ �������ӵ�ԭ�ӽṹʾ��ͼΪ
��2��Ԫ�ص�����������Ӧ��ˮ������������ǿ�� ��������ǿ���� �������Ե����������� ��
��3����Ҫ��д�������������ʵĵ���ʽ�������⻯�� ���������������Ķ�Ӧ��ˮ���� ��
��4�����������ĵ����У���ѧ���ʽϻ��õ��� ������ʲô��ѧ��Ӧ˵������ʵ��д����Ӧ�Ļ�ѧ����ʽ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
����
����ʽ��HCl
��Է���������36.5
�ܶȣ�1.19 g��cm-3
HCl������������36.5%
��1����Ũ������HCl�����ʵ���Ũ��Ϊ_________mol��L ��1 ��
��2��ȡ����������ĸ�������Һʱ�������������в�����ȡ����Ķ��ٶ��仯����________��
A����Һ��HCl�����ʵ��� B����Һ��Ũ��
C����Һ��Cl�� ����Ŀ D����Һ���ܶ�
��3��ijѧ��ȡ����Ũ����100mL��
������ˮϡ�͵�500 mL��������������ʵ���Ũ��Ϊ________mol��L ��1 ��
������ʹ����Һ������������Ϊԭ����![]() ��Ӧ�ü�______mL����ˮ��
��Ӧ�ü�______mL����ˮ��
������ʹ����Һ�����ʵ���Ũ�ȱ�Ϊԭ����![]() ���������ˮ�����______119mL���ÿ��>����<����=������
���������ˮ�����______119mL���ÿ��>����<����=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�к��д�����Ba2+��NH ![]() ��Cl�� �� �ڸ���Һ�л����ܴ������ڵ������ǣ� ��
��Cl�� �� �ڸ���Һ�л����ܴ������ڵ������ǣ� ��
A.Fe3+
B.CO ![]()
C.OH��
D.Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������У��������Ӽ������й��ۼ����ǣ�������
A.NaCl
B.Ca��OH��2
C.H2O
D.CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӵ�ʳ�Ρ������߸�ţ�̡������������ࡱ�������ճ�������Ӵ�����Ʒ������ĵ⡢�ơ���ָ���ǣ�������
A.Ԫ��
B.ԭ��
C.����
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ʺ���C��H��O��N��Ԫ�ء����й�����Ȼ���е�ѭ����˵���������
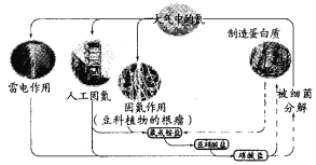
A. ��������ͺ����л�����ת��
B. ̼���⡢������Ԫ��Ҳ���ܲ����˵�ѭ��
C. ���ת��Ϊ�����Σ������˻�ԭ��Ӧ
D. Ŀǰ�˹��̵��ķ�ӦΪN2+3H2![]() 2NH3
2NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�ĵ绯ѧװ�ã������ھ������������ŷŷ�ˮ�е����أ�H2 NCON H2����ͬʱ�������ܣ������й�˵������ȷ���ǣ� ��
A.�Ҳ�Ķ��̼�缫��ԭ��صĸ���
B.�������Һ��Hʮ������ƶ�
C.�����Ϸ�����ԭ��Ӧ��H2NCONH2+H2O��6e���TCO2+N2+6H+
D.�缫�����ı�״����33.6LO2 �� ��·��ת��6 mol����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com