
| A. | 89.6L | B. | 44.8L | C. | 22.4L | D. | 11.2L |
分析 铜与稀硝酸发生反应为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,结合铜、硝酸的物质的量判断过量情况,然后根据不足量计算出生成NO的物质的量,再根据V=nVm计算出生成NO在标准状况下的体积.
解答 解:铜与稀硝酸发生反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,
3mol铜与稀硝酸完全反应需要消耗硝酸的物质的量为:3mol×$\frac{8}{3}$=8mol,则稀硝酸不足,
2mol硝酸完全反应生成NO的物质的量为:n(NO)=$\frac{1}{4}$n(HNO3)=0.5mol,
标准状况下0.5molNO的体积为:22.4L/mol×0.5mol=11.2L,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,根据反应原理及反应物的量正确判断过量情况为解答关键,注意掌握物质的量与气体摩尔体积、摩尔质量之间的关系,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,分子总数为NA的H2和O2混合气体,其体积约为22.4L | |
| B. | 5.6g铁与足量的氯气反应,转移电子数为0.2NA | |
| C. | 11.2LH2O所含有的原子数为1.5NA | |
| D. | 0.2mol/L的Na2CO3溶液中含有的Na+数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
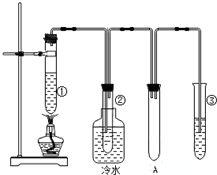 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.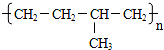 B.
B.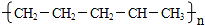
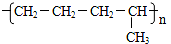 D.
D.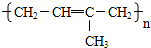
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol氦气含有的原子数为NA | |
| C. | 71gCl2所含原子数为NA | |
| D. | 23g钠在化学反应中得到的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Mg | |
| B. | 电池放电时,负极反应为Mg+2OH--2e-═Mg(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质在一定条件下能与Z的最高价氧化物发生置换反应 | |
| B. | 原子半径:Y>Z>W | |
| C. | 最高价氧化物对应水化物的酸性由弱到强的顺序:X<Z<W | |
| D. | 室温下,0.1mol/LW的气态氢化物的水溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:填空题
实验室常用盐酸的质量分数为36.5%,密度为1.20g/㎝3。
(1)此浓盐酸的物质的量浓度是 ?(列式计算)
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸 mL .(列式计算)
(3)还原4.8g金属氧化物,参加反应的氢气为2.016L(标准状况),生成的金属溶于上述盐酸,放出氢气1.344 L(标准状况),此金属氧化物是 。
A.Fe2O3 B.ZnO C.CuO
(4)将5.0 g CaC O3加入到足量的盐酸中,并将生成的气体全部通入足量的红热的碳中充分反应,可得到气体的体积为 。(折算成标况下)
O3加入到足量的盐酸中,并将生成的气体全部通入足量的红热的碳中充分反应,可得到气体的体积为 。(折算成标况下)
(5)某金属R与一定体积的上述盐酸正好完全反应所得氯化物溶液20 mL,浓度为0.05 mol/L。它恰好能与20 mL 0.15 mol·L-1 的AgNO3溶液完全反应,则该氯化物的化学式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com