
【题目】20℃时,饱和NaCl溶液的密度为ρ g·cm3,物质的量浓度为c mol/L,则下列说法中不正确的是 ( )
A. 温度低于20 ℃时,饱和NaC1溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为![]() ×100%
×100%
C. 将1 L该NaCl溶液蒸干可得到58.5c gNaCl固体
D. 20 ℃时,NaCl的溶解度S=![]() g
g
【答案】D
【解析】
A. 温度降低,氯化钠的溶解度减小,溶液中氯化钠的物质的量浓度减小;
B.根据c=![]() 可以知道,w=
可以知道,w=![]() 100%,据此解答;
100%,据此解答;
C.根据n=cV,m=nM计算溶质氯化钠的质量;
D. 设溶液体积为1L,根据氯化钠密度、浓度及溶解度表达式计算出该温度下的溶解度。
A. 温度低于20℃时,氯化钠饱和溶液中溶解的氯化钠减少,所以饱和NaCl溶液的浓度小于c mol/L,所以A选项是正确的;
B. 根据c=![]() 可以知道,w=
可以知道,w=![]() 100%=
100%=![]() ×100%,所以B选项是正确的;
×100%,所以B选项是正确的;
C. 1 Lc mol/LNaCl溶液中,n(NaCl)=cmol,m(NaCl)=58.5cg,则蒸干可得到58.5c gNaCl固体,所以C选项是正确的;
D. 20℃时,1L饱和NaCl溶液中溶解的氯化钠的质量为58.5cg,溶液质量为100![]() ,则该温度下氯化钠的溶解度为:S=
,则该温度下氯化钠的溶解度为:S=![]() 100g=
100g=![]() g,故D错误。
g,故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】香料M的一种合成流程如下:

已知:①![]()
②R1COOH![]() R1COOR
R1COOR
请回答下列问题:
(1)M中含碳的官能团名称是___________;设计R→X和Y→Z步骤的目的是___________。
(2)A→B的反应类型是___________,R分子中最多有___________个原子共平面。
(3)R和M在下列仪器中信号完全相同的是___________(填字母)
a红外光谱仪 b质谱仪 c元素分析仪 d核磁共振氢谱仪
(4)写出C和Z反应生成M的化学方程式:______________________。
(5)在Y的同分异构体中,同时满足下列条件的结构有___________种(不考虑立体异构)。
①能发生银镜反应
②遇氯化铁溶液发生显色反应
③1mol有机物最多能消耗3 mol NaOH
(6)已知苯环上有烃基时,新引入取代基主要取代邻位、对位氢原子。参照上述合成流程,设计以苯和异丙醇为原料制备Br![]() 的合成路线:_________________(无机试剂任选)
的合成路线:_________________(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.氯气能用来制取漂白粉
B.利用钠的强还原性,可置换出CuCl2稀溶液中的金属Cu
C.MgO的熔点很高,可用耐高温材料
D.高纯硅用来制造电脑芯片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作不正确的是( )
A.容量瓶用蒸馏水洗涤后须烘干才能使用
B.可以用10 mL量筒量取8.0 mL稀硫酸
C.配制氯化铁溶液时,可将氯化铁溶解在较浓的盐酸中,然后再加水稀释
D.蒸馏操作时先通冷却水再加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.石油裂化、裂解和分馏均为化学变化
B.煤焦油中可以分离出苯、甲苯、二甲苯等有机化合物
C.利用CO2制造全降解塑料能有效减少环境污染
D.生物质能来源于植物及其加工产品所贮存的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,图案上由左到右分别写了H2O、CO2、Na2O、NaCl、FeCl35种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
(____)两种物质都是非金属氧化物
(____)两种物质都是钠的化合物
(____)两种物质中一种是酸性氧化物,一种是碱性氧化物
(____)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为________。
②证明有红褐色胶体生成的最常用的实验操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
(1)水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是
(2)水的净化与软化的区别是
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=1.2×10﹣3mol/L,c(Mg2+)=6×10﹣4mol/L,则此水的硬度为 .
(4)若(3)中的天然水还含有c(HCO3﹣)=8×10﹣4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2 克,后加入Na2CO3 克.
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极.

①隔膜A是 (填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大量的Na+、Cl﹣,以及少量的K+、SO42﹣.若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用生产钛白的副产品FeSO4与软锰矿(主要成分是MnO2)可制备高纯MnO2。
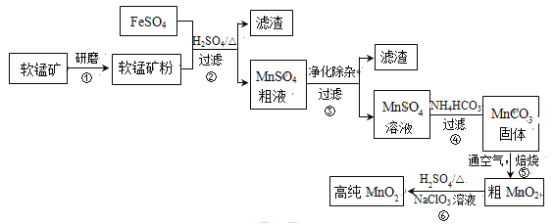
(1)步骤①中研磨的目的是_________。
(2)步骤②中主要发生的反应是FeSO4与MnO2转化为MnSO4与_________。
(3)步骤②中Mn2+浸出率受初始H2SO4浓度与温度的影响如下图所示。

软锰矿粉酸浸的适宜条件是__________。
(4)步骤②中,若硫酸初始浓度小于1.8mol/L,反应进行一段时间后,有红褐色固体析出,其原因是____________。
(5)已知MnSO4粗液中还含有Al3+、Fe3+和Ni2+离子,溶液中离子生成氢氧化物的pH如下表:
Al(OH)3 | Fe(OH)3 | Ni(OH)2 | Mn(OH)2 | |
开始沉淀时pH | 3.4 | 1.5 | 6.9 | 8.2 |
完全沉淀时pH | 4.7 | 2.8 | 8.9 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤③进行的操作是:调节pH=5.4,过滤,滤渣中含_____。
(6)已知:几种难溶物的溶解平衡常数K
化学式 | MnCO3 | NiCO3 | MnS | NiS |
K | 2.24×10-11 | 1.42×10-7 | 4.65×10-14 | 1.07×10-21 |
步骤③还需加入的除杂试剂是_______固体(填序号)。
a.Na2CO3 b.MnCO3 c.Na2S d.MnS
(7)步骤⑤中焙烧MnCO3制MnO2,发生反应的化学方程式是______。固体产物除MnO2外,还可能存在______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-丙二醇脱氧脱水反应的催化循环机理如下图所示。
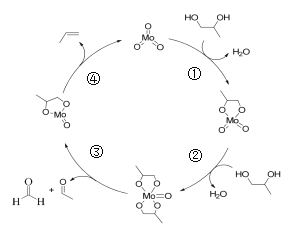
下列说法不正确的是
A. 产物CH2=CHCH3不存在顺反异构
B. 过程②中有O—H键发生断裂
C. 过程③④中均有C—C键发生断裂
D. 该反应方程式为:2CH2(OH)CH(OH)CH3![]() HCHO+CH3CHO+CH2=CHCH3+2H2O
HCHO+CH3CHO+CH2=CHCH3+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com