
ͨ�����·�Ӧ���ɻ�ȡH2�������й�˵����ȷ����
��̫������ֽ�ˮ���⣺2H2O(l)=2H2(g)+O2(g) ��H1=571.6kJ��mol�C1
�ڽ�̿��ˮ��Ӧ���⣺C(s)+H2O(g)=CO(g)+H2(g) ��H2=131.3kJ��mol�C1
�ۼ�����ˮ��Ӧ���⣺CH4(g)+H2O(g)=CO(g)+3H2(g) ��H3=206.1kJ��mol�C1
A����Ӧ���е���ת��Ϊ��ѧ��
B����Ӧ��Ϊ���ȷ�Ӧ
C����Ӧ��ʹ�ô�������H3��С
D����ӦCH4(g)=C(s)+2H2(g)�Ħ�H=74.8kJ��mol�C1

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���㽭ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�鷽���ܴﵽĿ�ĵ���
A����ȥFe���л��е�I2:����ʹI2����
B����ȥNaCl�����л��е�MgCl2:����KOH��Һ����ˣ���Һ�����ᾧ
C����ȥ̼�����л��е�̼�����ƣ��������������������Һ�������ᾧ
D����ȥ�����к��е��Ȼ������壺�ñ���ʳ��ˮϴ�Ӻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���㽭ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ʽ��ͬ�����Ȳ���ͬϵ��ֲ���ͬ���칹�����
A����ϩ��3����һ1һ��ϡ
B��������ϩ
C��1 һ�ȱ����2һ�ȱ���
D�������������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��������������ѧУ�߶��Ͻο�����ѧ���������棩 ���ͣ������
�ں�����������ʼʱ�ݻ���Ϊ5L�ļס������ܱ�������(��Ϊ������������Ϊ��ѹ����)�������з�Ӧ��N2(g)+3H2(g) 2NH3(g) ��H2=-92.4kJ/mol ���й����ݼ��ض�ƽ��״̬���±���
2NH3(g) ��H2=-92.4kJ/mol ���й����ݼ��ض�ƽ��״̬���±���
���� | ��ʼͶ�� | ��ƽ��ʱ | ||
�� | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 |
�� | amolN2 | bmolH2 | 0molNH3 | 1.2molNH3 |
(1)��ƽ���ͬ�����ʵ����������ͬ����ʼʱ������ͨ���N2�����ʵ���Ϊ ����ʼʱ���е�ѹǿ�Ǽ������� �����ҵ�ƽ�ⳣ��Ϊ
(2)�����ܱ������п��Է��������ķֽⷴӦ����ƽ����ı��±��з�Ӧ����x�����и�����y��x�������������� (ѡ�����)��
a | b | c | d | |
x | �¶� | �¶� | ����H | ���백�������ʵ��� |
y | ��������ƽ����Է������� | ƽ�ⳣ��K | ���������ܶ� | ��ƽ��ʱ������ת���� |
(3)�о���������������ʱ���ı���ʼ�����������ʵ����Է�Ӧ��Ӱ �죬ʵ������ͼ��ʾ(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)��
�죬ʵ������ͼ��ʾ(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)��
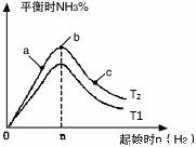
����T2��T1�Ĺ�ϵ�ǣ�T2 T1(����ڡ������ڡ������ڡ�����ȷ����)��
��a��b��c�����У�N2ת������ߵ��� (����ĸ)��
���������ݻ�Ϊ1L��T2������ʼ��ϵ�м���1molN2��3molH2������5min��Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����NH3�ķ�Ӧ����Ϊ ����������������䣬����ʼʱ�������ڷ���2molN2��6molH2����ƽ ���ų�������ΪQ����Q_________110.88kJ(�
���ų�������ΪQ����Q_________110.88kJ(� >������<����=��)��
>������<����=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��������������ѧУ�߶��Ͻο�����ѧ���������棩 ���ͣ�ѡ����
K2Cr2O7��Һ�д���ƽ�⣺Cr2O72-(��ɫ)+H2O 2CrO42-(��ɫ)+2H+����K2Cr2O7��Һ��������ʵ�飺
2CrO42-(��ɫ)+2H+����K2Cr2O7��Һ��������ʵ�飺
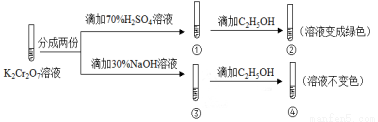
���ʵ�飬����˵������ȷ����
A��������Һ��ɫ���������Һ���
B������Cr2O72-��C2H5OH��ԭ
C���ԱȢںܿ͢�֪K2Cr2O7������Һ������ǿ
D��������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��������������ѧУ�߶��Ͻο�����ѧ���������棩 ���ͣ�ѡ����
��֤�������������ʵ����ʵ��
A��CH3COOH��Һ��Zn��Ӧ�ų�H2
B��0.1mol/L CH3COONa��Һ��pH����7
C��CH3COOH��Һ��NaCO3��Ӧ����CO2
D��0.1 mol/L CH3COOH��Һ��ʹ��ɫʯ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶����¿�����ѧ�Ծ��������棩 ���ͣ������
�ɣ�ij��Ԫ��(��ѧʽ��H2A��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�H2A �� H�� �� HA����HA�� H����A2�����ش��������⣺
H����A2�����ش��������⣺
��1����0.1mol��L��1��Na2A��Һ�У�������Ũ�ȹ�ϵ����ȷ����_________��
A��c(A2��)��c(HA��)��c(H2A)��0.1mol��L��1
B��c(OH��)��c(H��)��c(HA��)
C��c(Na��)��c(H��)��c(OH��)��c(HA��)��2c(A2��)
D��c(Na��)��2c(A2��)��2c(HA��)
��2����֪0.1mol��L��1NaHA��Һ��pH��2����0.1mol��L��1H2A��Һ�������ӵ����ʵ���Ũ��________(�����������������)0.11mol��L��1��
II��������(H3PO3)�Ƕ�Ԫ�ᣬH3PO3��Һ���ڵ���ƽ�⣺H3PO3 H+ +H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
H+ +H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
��1����ij�¶��£�0.1000 mol��L-1��H3PO3��Һ��c (H+) = 2.5��10����mol��L-1����OH-֮���������ӵ�Ũ���ɴ�С��˳���� ��
��д��������������NaOH��Һ��Ӧ�����ӷ���ʽ ��
III������̼���á�ʱ������ѧ�����á����ת�����ȼ�����CO2�����ۺ����á�
��1��CO2��H2��һ�������¿���������ϩ��6H2(g)+2CO2(g) CH2==CH2(g)+4H2O(g) ��H=a kJ��mol-1 ��֪��H2(g)��ȼ����Ϊ285.8 kJ��mol-1��CH2=CH2(g)��ȼ����Ϊ1411.0 kJ��mol-1��H2O(g)= H2O(l) ��H=-44.0 kJ��mol-1����a=______kJ��mol-1��
CH2==CH2(g)+4H2O(g) ��H=a kJ��mol-1 ��֪��H2(g)��ȼ����Ϊ285.8 kJ��mol-1��CH2=CH2(g)��ȼ����Ϊ1411.0 kJ��mol-1��H2O(g)= H2O(l) ��H=-44.0 kJ��mol-1����a=______kJ��mol-1��
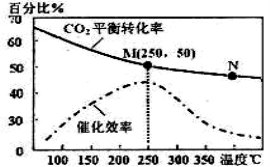
��2������������ϩ�ķ�Ӧ�У��¶ȶ�CO2��ƽ��ת���ʼ������Ĵ�Ч��Ӱ��������ͼ�������й�˵������ȷ����_______(�����)
���¶�Խ�ߣ������Ĵ�Ч��Խ��
��M��ƽ�ⳣ����N��ƽ�ⳣ����
���¶ȵ���250��ʱ�������¶����ߣ���ϩ�IJ�������
������ѹǿ�������ϩ���������
��N������Ӧ����һ������M������Ӧ����
IV��Ϊ���������Ⱦ����������β���ŷŴ���װ��ת��װ�ã���Ӧ����ʽΪ��
2NO(g)+2CO(g) 2CO2(g)+N2(g)��
2CO2(g)+N2(g)��
��3������500��ʱ��Ͷ��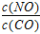 =1 ��NO����ʼŨ��Ϊamol/L,NO��ת����Ϊ80��������¶�ʱ��ƽ�ⳣ��K=________��
=1 ��NO����ʼŨ��Ϊamol/L,NO��ת����Ϊ80��������¶�ʱ��ƽ�ⳣ��K=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶����¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��(NH4)2CO3(s)�TNH4HCO3(s)+NH3(g)��H=+74.9kJ��mol��1������˵������ȷ����( )
A���÷�Ӧ�����ȷ�Ӧ�����һ�������Է�����
B���÷�Ӧ���ر䡢�ʱ�Դ���0
C��̼���ηֽⷴӦ�������ӣ�����κ�����������̼���ηֽ�һ���Է�����
D�����Է����еķ�Ӧһ���Ƿ��ȷ�Ӧ�������Է����еķ�Ӧһ�������ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꺣��ʡ�߶��������Ļ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʲ���Ϊ���ಹ����������
��.���� B.ˮ C.������ D.��֬
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com