
【题目】请根据要求填写下列空白:
(1)NaHCO3溶液呈碱性的原因是 ______________(用方程式和必要文字表示),写出该溶液存在的物料守恒的关系式 ________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要产物是________________________。
(3)若想除去CuCl2 溶液中混有FeCl3杂质,则往往加入试剂 ______________。
①NaOH ②NH3·H2O ③CuO ④CuCO3
(4)在酸碱滴定中,我们用0.1000mol/L HCl来滴定未知浓度的NaOH溶液,①在滴定过程中,操作或说法错误的是_______________。
a.滴定终点为:当滴完最后一滴恰好变色,且在半分钟内不恢复原色
b.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
c.酸式滴定管中的盐酸装液前未经润洗,导致所测定的c(NaOH)偏低。
d.酸式滴定管在滴定前有气泡,滴定后气泡消失,导致所测定的c(NaOH)偏高
②某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠 溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=________________
【答案】溶液中存在的HCO3-水解平衡和电离平衡:HCO3-+H2O![]() H2CO3+OH-;HCO3-
H2CO3+OH-;HCO3-![]() H++CO32-;HCO3-水解程度> HCO3-电离程度,所以溶液显碱性 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) Al2O3 ③④ bc 0.1044mol/L
H++CO32-;HCO3-水解程度> HCO3-电离程度,所以溶液显碱性 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) Al2O3 ③④ bc 0.1044mol/L
【解析】
(1)根据HCO3-电离程度和水解程度分析判断;结合物料守恒判断;
(2)根据盐水解产物的稳定性和易挥发性分析;
(3)除去杂质不能引入新的杂质离子;
(4)①根据c=![]() 分析误差,结合滴定操作方法判断操作正误;
分析误差,结合滴定操作方法判断操作正误;
②先对实验数据进行处理,计算出消耗标准酸溶液的体积,根据n(NaOH)=n(HCl)计算氢氧化钠溶液的物质的量浓度。
(1)NaHCO3是强碱弱酸,在溶液中HCO3-既存在电离作用:HCO3-![]() H++CO32-;也存在水解作用:HCO3-+H2O
H++CO32-;也存在水解作用:HCO3-+H2O![]() H2CO3+OH-;电离产生H+使溶液显酸性,水解产生OH-,使溶液显碱性,由于HCO3-水解程度>HCO3-电离程度,所以溶液中c(OH-)>c(H+),因此溶液显碱性;
H2CO3+OH-;电离产生H+使溶液显酸性,水解产生OH-,使溶液显碱性,由于HCO3-水解程度>HCO3-电离程度,所以溶液中c(OH-)>c(H+),因此溶液显碱性;
NaHCO3电离方程式为NaHCO3=Na++HCO3-,HCO3-极易电离产生CO32-,也水解产生H2CO3,但主要以HCO3-存在,根据C元素守恒可知c(HCO3-) (始)=c(HCO3-)+c(CO32-)+c(H2CO3),根据盐电离方程式可知c(Na+)=c(HCO3-) (始),所以c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3);
(2)将AlCl3溶液蒸干时,铝离子水解生成Al(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到Al(OH)3,灼烧氢氧化铝时,氢氧化铝会分解产生Al2O3,反应方程式为2 Al(OH)3![]() Al2O3+3H2O,所以最终得到的是固体Al2O3;
Al2O3+3H2O,所以最终得到的是固体Al2O3;
(3)由于FeCl3形成Fe(OH)3沉淀需要的pH较小,而CuCl2形成Cu(OH)2沉淀需要的pH较大,可以通过加入物质,消耗溶液中的H+,使pH增大到Fe3+形成沉淀而Cu2+仍然以离子形式存在于溶液中,同时不引入其它杂质离子的方法,根据题干提供的物质,可知需加入CuO、CuCO3,而NaOH会引入杂质Na+,NH3·H2O会引入杂质NH4+,故合理选项是③④;
(4)①a.滴定终点为:当滴完最后一滴恰好变色,且在半分钟内不恢复原色,说明恰好达到滴定终点,不产生误差,a合理;
b.进行中和滴定操作时,应该左手转动活塞控制液滴流速,右手振荡锥形瓶,眼睛要始终注视锥形瓶中溶液颜色变化,b操作不合理;
c.酸式滴定管中的盐酸装液前未经润洗,导致标准溶液的浓度偏小,使的消耗标准酸溶液的体积偏大,则所测定的c(NaOH)偏高,c误差分析不合理;
d.酸式滴定管在滴定前有气泡,滴定后气泡消失,则消耗标准酸酸溶液体积偏大,导致所测定的c(NaOH)偏高,d正确;
故合理选项是bc;
②根据实验数据可知第二次的数据偏差较大,舍去,消耗标准酸溶液的体积V=![]() =26.10mL,HCl与NaOH反应的物质的量的比是1:1,所以c(NaOH)·V(NaOH)= c(HCl)·V(HCl),因此c(NaOH)=
=26.10mL,HCl与NaOH反应的物质的量的比是1:1,所以c(NaOH)·V(NaOH)= c(HCl)·V(HCl),因此c(NaOH)=![]() =0.1044mol/L。
=0.1044mol/L。


科目:高中化学 来源: 题型:
【题目】25℃时,某溶液中由水电离出的c(OH-)=1×10-13mol/L,该溶液中一定不能大量共存的离子组是( )
A.NH![]() 、Fe3+、SO
、Fe3+、SO![]() 、Cl-B.CO
、Cl-B.CO![]() 、PO
、PO![]() 、K+、Na+
、K+、Na+
C.Na+、SO![]() 、NO
、NO![]() 、Cl-D.HPO
、Cl-D.HPO![]() 、Na+、HSO
、Na+、HSO![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:![]() ,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:

![]() 反应方程式中的
反应方程式中的![]() _______,30min时改变的反应条件是_______。
_______,30min时改变的反应条件是_______。
![]() 时反应的平衡常数_______
时反应的平衡常数_______![]() 时反应的平衡常数
时反应的平衡常数![]() 填:
填:![]() 、
、![]() 或
或![]() 。
。
![]() 该反应的正反应为________
该反应的正反应为________![]() 填:“放热”或“吸热”
填:“放热”或“吸热”![]() 反应。
反应。
![]() 反应过程中B的转化率最大的时间段是____________。
反应过程中B的转化率最大的时间段是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的第二、三周期主族元素,A、B、C的单质(用a、b、c表示)及其化合物x、y、z有如下转化关系,D与B同主族,下列说法正确的是

A. x、y、z均是离子化合物
B. 简单氢化物的沸点:C﹥B﹥D
C. 最高价氧化物对应的水化物的酸性:A﹥D
D. 简单离子半径:D﹥C﹥B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
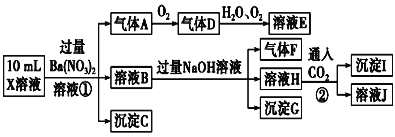
A.气体A是NO2
B.X溶液中肯定存在Fe2+、Al3+、![]() 、
、![]()
C.溶液E和气体F不能发生化学反应
D.X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.  催化剂活性
催化剂活性![]()
B. 
![]()
![]() ,在恒容绝热容器中投入一定量
,在恒容绝热容器中投入一定量![]() 和
和![]() ,正反应速率随时间变化
,正反应速率随时间变化
C. 
![]()
![]() ,t时刻改变某一条件,则
,t时刻改变某一条件,则![]()
D.  向等体积等pH的HCl和
向等体积等pH的HCl和![]() 中加入等量且足量Zn,反应速率的变化情况
中加入等量且足量Zn,反应速率的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对H2O2的分解速率影响因素进行研究。在相同温度下,实验测得不同条件下出O2浓度随时间变化如图所示。下列说法不正确的是( )
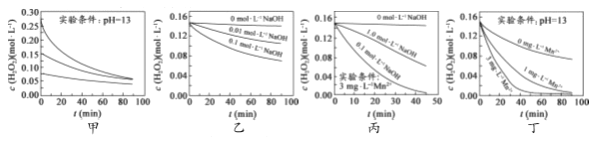
A. 图甲表明,可通过适当增大H2O2浓度,加快H2O2分解速率
B. 图乙表明,可通过调节溶液的酸碱性,控制H2O2分解速率快慢
C. 图丙表明,Mn2+少量存在时,碱性太强,不利于H2O2分解
D. 图乙、图丙和图丁表明,Mn2+是H2O2分解的催化剂,提高Mn2+的浓度就能增大H2O2 分解速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com