
分析 太阳光分解海水时,太阳能转化为化学能,二氧化钛做催化剂;
物质的分解反应是吸热反应;
燃料电池是将化学能转变为电能的装置;
燃料电池的正极上是氧气发生得电子的还原反应,据此书写电极方程式.
解答 解:太阳光分解海水时,太阳能转化为化学能,水难以分解,在二氧化钛(TiO2)表面作用使海水分解得到氢气;
水分解时,水分子中的H-O断裂生成氧原子和氢原子,该反应吸热;
生成的氢气用于燃料电池,实现了将化学能转变为电能;
燃料电池的正极上是氧气发生得电子的还原反应,在酸性环境下,电极方程式为:O2+4H++4e-═2H2O;
故答案为:太阳;化学;吸热;化学;电;O2+4H++4e-═2H2O.
点评 本题考查了能量的转化形式及反应中的热效应等知识点,题目难度不大,注意掌握常见的能量转化形式,明确化学反应与能量变化的关系.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方案 | 实验目的 | |
| A | 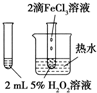 | 验证FeCl3对H2O2分解反应有催化作用 |
| B | 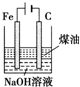 | 制备Fe(OH)2并能较长时间观察其颜色 |
| C | 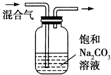 | 除去CO2气体中混有的SO2 |
| D | 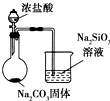 | 比较Cl、C和Si的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以B表示的平均反应速率为v(B)=0.0625mol•L-1•s-1 | |
| B. | 4min时,A的物质的量为0.75mol | |
| C. | 该反应方程式中,x=2 | |
| D. | 4min时,B的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
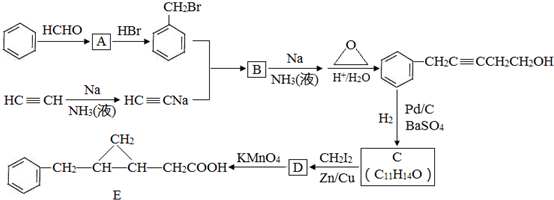
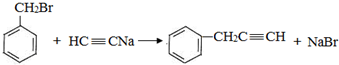 ,反应类型是取代反应.
,反应类型是取代反应.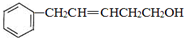 ,C的分子中一定共面的碳原子最多有7个.
,C的分子中一定共面的碳原子最多有7个.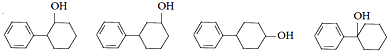 任意2种.
任意2种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
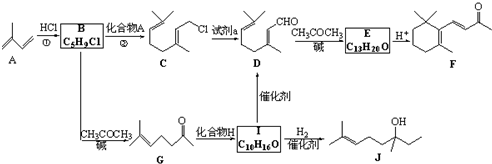
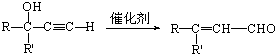 (R和R′表示烃基或氢)
(R和R′表示烃基或氢)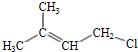 .
.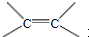 .
.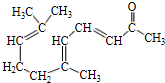 .
.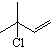 b.反应②的反应类型是加成反应
b.反应②的反应类型是加成反应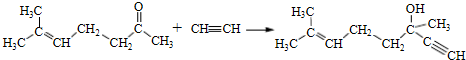 .
.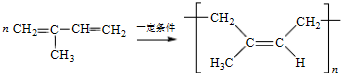 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)=0.1 mol•L-1 | |
| B. | 0.2 mol•L-1NaHS溶液和0.1 mol•L-1Na2S溶液等体积混合,混合液中:3c(Na+)=4c(H2S)+4c(HS-)+4c(S2-) | |
| C. | KAl(SO4)2的水溶液中:c(SO42-)>c(A13+)>c(K+)>c(H+)>c(OH-) | |
| D. | H2SO3溶液中:c(H+)=2c(SO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
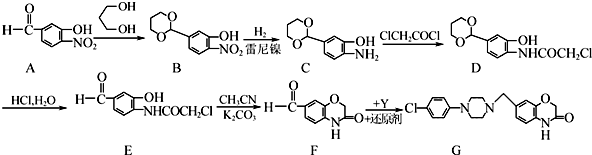
 的名称为1,3丙二醇;设计步骤A→B的目的是保护醛基,防止被还原.
的名称为1,3丙二醇;设计步骤A→B的目的是保护醛基,防止被还原. .
.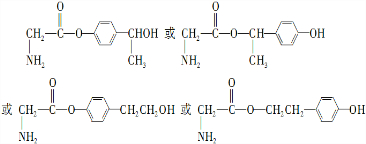 .
.
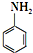 易氧化,酰胺基(
易氧化,酰胺基(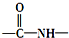 )难以被H2还原.
)难以被H2还原.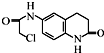 )是合成一种新型口服强心药的中间体,请写出以
)是合成一种新型口服强心药的中间体,请写出以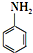 、ClCH2CH2COCl、ClCH2COCl为原料制备Z的合成路线流程图(无机试剂可任选).
、ClCH2CH2COCl、ClCH2COCl为原料制备Z的合成路线流程图(无机试剂可任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com