
某温度下1 L密闭容器中加1 mol N2和3 mol H2,使反应N2+3H2![]() 2NH3达到平衡,测得平衡混合气体中N2、H2,NH3物质的量分别为m mol,n mol,q mol.如温度不变,只改变初始加入的物质的量,而要求m、n、q的值维持不变,则N2,H2,NH3加入的物质的量用x、y、z表示时,应满足条件:
2NH3达到平衡,测得平衡混合气体中N2、H2,NH3物质的量分别为m mol,n mol,q mol.如温度不变,只改变初始加入的物质的量,而要求m、n、q的值维持不变,则N2,H2,NH3加入的物质的量用x、y、z表示时,应满足条件:
(1)若x=0,y=0,则z=________.
(2)若x=0.75 mol,则y=________,q=________
(3)x、y、z应满足的一般条件是(请用两上方程式表示,其中一个含x和y,另一个只含y和z)________.
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
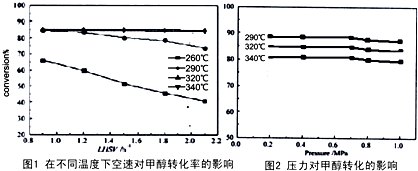
 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| c(CH3OH)/mol?L-1 | 0.51 | 0.2 | 0.1 | 0.01 | 0.01 |
| ||||
|
| 32Cw |
| 32Cw+9CM) |
| ||||
|
| 32Cw |
| 32Cw+9CM) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 时间/S | c(CO2)mol/L | c(H2)mol/L |
| 0 | 1.00×10-1 | 3.00×10-1 |
| 1 | 8.50×10-2 | 2.55×10-1 |
| 2 | 6.50×10-2 | 1.95×10-1 |
| 3 | 5.50×10-2 | 1.65×10-1 |
| 4 | 5.00×10-2 | 1.50×10-1 |
| 5 | 5.00×10-2 | 1.50×10-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度/℃、00w | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 原料转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
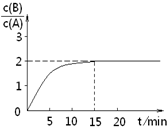 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:| A、反应在前15min的平均速率ν(A)=0.11 mol?L-1?min-1 | B、A的初始物质的量为8 mol | C、反应到达平衡的过程中,放出的热量是77.2kJ | D、如使反应最终c(B)/c(A)=1.5,恒温恒容时,加入一定量的A可以实现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com