
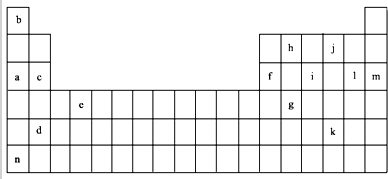
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
 .
.分析 a为Na、b为H、c为Mg、d为Dr、e为Ti、f为Al、g为Ge、h为C、i为P、j为O、k为Te、l为Cl、m为Ar、n为Cs,
(1)多数金属元素、碳元素为良好的导体,注意m在自然界中不能稳定存在;
(2)①根据达到稳定结构后再失去电子所需能量较高分析;
②Y原子失去核外第四个电子时所需的能量要远远大于失去第三个电子所需的能量,所以Y最外层含有3个电子,为Al元素;X原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量,且其第一电离能稍小于Li,所以为Na元素,Na与O按照1:1形成的化合物为过氧化钠,写出过氧化钠的电子式;
(3)e为22号元素Ti,核外电子总数为22,根据构造原理写出其核外电子排布式;
(4)稀有气体元素最外层达到稳定结构,其失去第一个电子需要能量较大;
(5)金属性越强,对应最高价氢氧化物的碱性越强;氧化铝与氢氧化钠反应生成偏铝酸钠和水.
解答 解:a为Na、b为H、c为Mg、d为Dr、e为Ti、f为Al、g为Ge、h为C、i为P、j为O、k为Te、l为Cl、m为Ar、n为Cs,
(1)表中各元素中,可以作良好导体的有:acdefhn,故答案为:acdefhn;
(2)①由于Li原子失去1个电子后形成稳定结构,再失去1个电子很困难,所以锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量,
故答案为:Li原子失去1个电子后形成稳定结构,再失去1个电子很困难;
②Y原子失去核外第四个电子时所需的能量要远远大于失去第三个电子所需的能量,所以Y最外层含有3个电子,为Al元素;X原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量,说明X最外层含有1个电子,且其第一电离能稍小于Li,所以为Na元素,元素符号表示Na和j按原子个数1:1形成化合物为Na2O2,过氧化钠为离子化合物,其电子式为: ,
,
故答案为:Al; ;
;
(3)Ti的原子序数为22,其基态原子的核外电子排布为:1s22s22p63s23p63d24s2,
故答案为:1s22s22p63s23p63d24s2;
(4)上述元素中,Ar为稀有气体,最外层为8电子稳定结构,其失去第一个电子所需能量最大,故答案为:Ar;
(5)金属性:Na>Mg>Al,则对应的最高价氧化物的水化物的碱性大小为:NaOH>Mg(OH)2>Al(OH)3;氧化铝与氢氧化钠溶液反应的离子方程式为:2OH-+Al2O3=AlO2-+2H2O
故答案为:NaOH>Mg(OH)2>Al(OH)3;2OH-+Al2O3=AlO2-+2H2O.
点评 本题考查了元素周期表、元素周期律的综合应用,题目难度中等,熟练掌握元素周期律结构、元素周期律的内容为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力.


科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既是离子键、又有非极性共价键 | |
| B. | 既有极性共价键,又有非极性共价键 | |
| C. | 都是非极性共价 | |
| D. | 都是极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
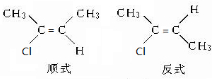 .
.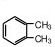 (结构简式)在苯环上的二溴代物只有两种.
(结构简式)在苯环上的二溴代物只有两种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(A-n+8)m}{A+16}$mol | B. | $\frac{(A-n+10)m}{A+16}$ mol | C. | (A-n+2)mol | D. | (A-n+6)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
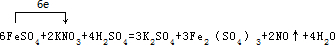 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化还原反应前后元素化合价有升降 | |
| B. | 氧化还原反应前后一定有氧的得失 | |
| C. | 氧化还原反应前后一定有电子转移 | |
| D. | 复分解反应和化合反应一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com