
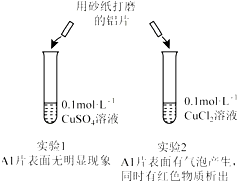
| A. | 由实验1 可以得出结论:金属铝的活泼性弱于金属铜 | |
| B. | 实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu | |
| C. | 溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因 | |
| D. | 由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2mol•L-1的盐酸和硫酸反应,后者更剧烈 |
分析 A.没有明显现象,不能比较金属的活泼性;
B.电荷不守恒;
C.实验2现象明显,说明阴离子不同导致现象不同;
D.氢离子浓度不同,与本实验无关.
解答 解:A.没有明显现象,只能说明反应没发生,客观事实是金属活泼性是铝大于铜,故A错误;
B.生成红色固体的反应是2Al+3Cu2+═2Al3++3Cu,故B错误;
C.由实验1、2 的对比实验可知产生不同现象的原因是溶液中的阴离子不同导致的,故C正确;
D.铝片在等浓度的盐酸和硫酸中反应,因硫酸中的H+的浓度大,所以在硫酸中反应剧烈,与本实验无关,故D错误.
故选C.
点评 本题考查物质的性质探究实验,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验原理的探究,难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
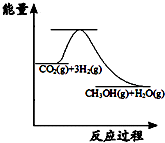 目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);图表示该反应进行过程中能量的变化.(单位为:kJ•mol-1)该反应是放热(填“吸热”或“放热”)反应.△H<0(填“>”或“<”).
目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);图表示该反应进行过程中能量的变化.(单位为:kJ•mol-1)该反应是放热(填“吸热”或“放热”)反应.△H<0(填“>”或“<”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
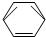 -CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH
-CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH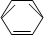 +HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O
+HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子量的递增,量变引起质变 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表是元素周期律的具体表现形式 | |
| B. | 元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化 | |
| C. | 同周期第IA族与第VA族原子序数之差可能是4、14、28 | |
| D. | 同主族原子序数之差不可能是:10、16、18、26、34、36、50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
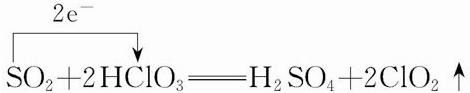 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com