
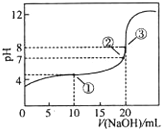
 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )| A、该中和滴定过程,最宜用石蕊作指示剂 |
| B、图中点②所示溶液中,c(CH3COO-)=c(Na+) |
| C、图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
| D、滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 |


科目:高中化学 来源: 题型:
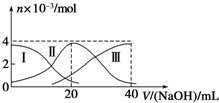 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| B、等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水大 |
| C、NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) |
| D、向上述加入20mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
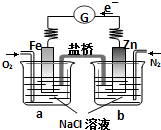
| A、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| B、烧杯a中发生反应O2+2H2O-4e-═4OH-,溶液pH升高 |
| C、向烧杯a中加入少量K3Fe(CN)6溶液,有蓝色沉淀生成 |
| D、烧杯b中发生的电极反应为Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气中有NOx,主要是汽油不充分燃烧引起的 |
| B、日用铝制品表面覆盖着氧化膜,对金属起保护作用 |
| C、实验室常用粗锌和稀硫酸反应制取H2 |
| D、从海水中提取溴的过程涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的 Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 配制FeCl2溶液时,先将FeCl2溶于适量稀盐再用蒸馏水稀释,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 |
| B、铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀 |
| C、二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |
| D、次氯酸钠具有强氧化性,可用于配制消毒液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、NO2和CO2都属于酸性氧化物 |
| B、甲烷和和一氯甲烷都属于烷烃 |
| C、HC1O是弱电解质,NaClO却属于强电解质 |
| D、在水溶液中能电离出H+的化合物都属于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、Y2+的半径比T2-的半径大 |
| C、Z2R3不能在水溶液中存在 |
| D、元素X和T形成的化合物中不可能含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com