
| A. | 甲烷 | B. | 石墨 | C. | 晶体硅 | D. | 水晶 |
科目:高中化学 来源: 题型:解答题
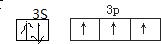 ;氧原子核外电子云有4 种不同的伸展方向,其最外层有6 种不同运动状态的电子.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.
;氧原子核外电子云有4 种不同的伸展方向,其最外层有6 种不同运动状态的电子.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将三氯化铁溶液蒸干,可制得无水三氯化铁 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂,说明Al(OH)3具有漂白性 | |
| C. | 含1molKOH的溶液与1molCO2完全反应后,溶液中c(K+)=c(HCO3-) | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
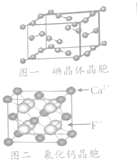 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解| 氯 | 氧 | 溴 | 碘 | 镀 | |
| 第一电离能(kj/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com