
| A. | 1.6 mol/(L•s) | B. | 0.08 mol/(L•s) | C. | 0.16 mol/(L•s) | D. | 0.8 mol/(L•s) |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
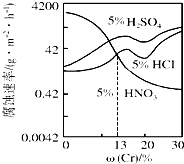 随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )| A. | 稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 | |
| B. | 随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 | |
| C. | Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 | |
| D. | 酸对Fe-Cr合金的腐蚀与阴离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
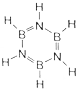 氮元素是一种常见元素,能形成多种化合物.
氮元素是一种常见元素,能形成多种化合物.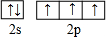 ,等物质的量的NH3和N2组成的混合气体中σ键和π键的物质之比为2:1.
,等物质的量的NH3和N2组成的混合气体中σ键和π键的物质之比为2:1.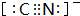 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | $\frac{4-n}{6-n}$ | C. | $\frac{n-4}{6-n}$ | D. | $\frac{1}{m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
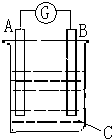 请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,
请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn是正极,Ag2O是负极 | |
| B. | 使用过程中,电子由Ag2O极经外路流向Zn极 | |
| C. | 使用过程中,电极负极区溶液的pH减小 | |
| D. | Zn电极发生氧化反应,Ag2O电极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属的冶炼方法有4种,其中铝热反应属于热分解法 | |
| B. | 海带中碘元素的检验原理:2H++2I-+H2O2=I2+2H2O | |
| C. | 石油的分馏,裂化,裂解,催化重整中裂化是物理变化 | |
| D. | 铝热反应中铝做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中少量的苯酚可先加适量的浓溴水,使之生成三溴苯酚,再过滤除去 | |
| B. | 将苯酚晶体放入少量水中,加热时全部溶解,冷却后溶液仍澄清透明 | |
| C. | 苯酚的酸性很弱,不能使指示剂变色,但可以与NaCHO3反应放出CO2 | |
| D. | 苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com