
2014 年 3 月 21 日是第二十二届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的____________倍。
2)某无色废水中可能含有 Fe3+、Al3+、Mg2+、Na+、NO-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品 100 mL,进行了三组实验,其操作和有关现象如下图所示:
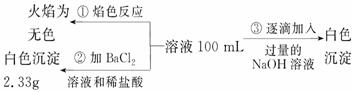
请根据上图回答下列问题:
①实验中需配制 1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管, 还缺少的仪器为_________。
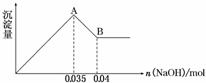
②实验③中沉淀量由 A→B过程中所发生反应的离子方程式为__________。
③试确定NO3-是否存在?_______(填“存在”、“不存在”或“不确定”),若存在,试计算 c(NO3-)=____________(若不存在,此问不必作答)。
【知识点】元素化合物、离子推断A3 B1 D5 C5
【答案解析】(1)2.5
(2)①100mL容量瓶 ②Al(OH)3+OH-=AlO2-+2H2O ③存在 0.15mol/L
解析:⑴消耗1mol ClO2得到电子5mol、消耗1molCl2得到电子2mol,ClO2的消毒效率是Cl2的2.5倍⑵根据废水无色知无Fe3+,根据焰色反应呈无色知没有Na+,根据实验②产生白色沉淀知有SO42-,而且其物质的量为2.33/233=0.01mol,根据实验③确定有Al3+和Mg2+,因为CO32-与Al3+不能共存,所以无CO32-,因此溶液中存在的离子为:Al3+、Mg2+、SO42-,根据图象可知Al(OH)3的物质的量为0.005mol,溶解氢氧化铝消耗OH-为0.005mol,生成氢氧化铝沉淀消耗OH-为0.015mol,则生成氢氧化镁沉淀消耗OH-为0.035mol-0.015mol=0.02mol,则Mg2+为0.01mol,根据电荷守恒知NO3-的物质的量为0.005×3+0.01×2-0.01×2=0.015mol,c(NO3-)=0.15mol/L;A→B段的反应是氢氧化铝的溶解Al(OH)3+OH-=AlO2-+2H2O;配制 1.0 mol/L的NaOH溶液100 mL还需100mL容量瓶。
【思路点拨】根据离子共存和实验现象分析判断离子组成;根据物质发生的反应及图像的起点、转折点、终点和曲线变化的意义进行分析计算。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
我国农业因遭受酸雨而造成每年高达15亿多元的损失。为有效地控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。回答下列问题:
在英国进行的一个研究结果表明:高烟囱可以有效地降低地面SO2的浓度。
在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,
但由于建造高烟囱的结果,地面浓度降低了30%之多。请你从全球环境保护
的角度,分析这种方法是否可取?简述其理由。
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧层是地命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2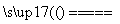 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,计算所得混合气体的平均摩尔质量(保留一位小数)。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为多少L?
查看答案和解析>>
科目:高中化学 来源: 题型:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个电池。请填写下列空白:
(1)实验原理:Fe+2H+===Fe2++H2↑
(2)实验用品:电极(________、________)、稀硫酸、________、________、耳机(或者电流计)(填写所缺的实验用品)。
(3)实验装置如图。
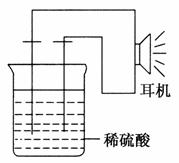
(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则________应该接电流计的负极,电极反应是________,发生了________反应;________应该接电流计的正极,电极反应是________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸钠过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.77g样品,配制成100.00 mL溶液A。
②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.582 5 g。
③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.02 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。回答下列问题:
(1)①不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号) :
A、在溶解过程中有少量液体溅出烧杯外
B、定容时仰视仪器上的刻度线
C、定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
(2) ③中配好的KMnO4溶液置于 (“酸式”或“碱式”)滴定管,判断滴定终点的实验现象是
(3)通过计算确定样品的组成 (写出简单计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,离子方程式正确的是()
A. 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
B. 碳酸钙跟盐酸反应:CO32﹣+2H+=H2O+CO2↑
C. 稀硫酸跟氢氧化钾溶液反应:H++OH﹣═H2O
D. 氢氧化钡溶液跟稀硫酸反应:Ba2++SO42﹣═BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
除去粗盐中的Ca2+、Mg2+、SO42﹣以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐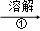
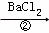
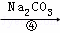
 滤液
滤液 
 粗盐
粗盐
(1)判断BaCl2已过量的方法是继续滴加氯化钡溶液不再出现沉淀.
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)l.
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是在..
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g.此混合气体中C和O两种原子的物质的量之比为()
A. 4:3 B. 3:4 C. 2:1 D. 1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com