
| A. | 用小苏打(NaHCO3)治疗胃酸(HC1)过多:CO32-+2H+═CO2↑+H2O | |
| B. | 氯化铁溶液腐蚀铜箔制印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | Fe3+与I-反应的离子方程式为:Fe3++2I-═Fe2++I2 |
分析 A.碳酸氢根离子不能拆开;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.氢氧化镁与盐酸反应生成氯化镁和水;
D.离子方程式两边总电荷不相等,违反了电荷守恒.
解答 解:A.用小苏打(NaHCO3)治疗胃酸(HC1)过多,碳酸氢根离子需要保留整体形式,正确的离子方程式为:HCO3-+H+═CO2↑+H2O,故A错误;
B.氯化铁溶液腐蚀铜箔制印刷线路板,反应生成氯化亚铁和氯化铜,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故B错误;
C.氢氧化镁溶于盐酸,氢氧化镁需要保留化学式,该反应的离子方程式为:Mg(OH)2+2H+═Mg2++2H2O,故C正确;
D.Fe3+与I-反应生成亚铁离子和碘单质,正确的离子方程式为:2Fe3++2I-═2Fe2++I2,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液可为LiCl水溶液 | |
| B. | 放电时负极反应式为:Li-e-+Cl-=LiCl | |
| C. | 放电时正极反应式为:2SOCl2+4e-=4Cl-+S+SO2 | |
| D. | 放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准情况下,22.4L CH4与18gH2O含有的分子数均为NA | |
| B. | 0.1mol•L-1的FeCl3溶液中含有Fe3+的数目小于0.1NA | |
| C. | 0.1molNa2O2中含有的阴离子的数目为0.2NA | |
| D. | 0.1mol铁粉与足量水蒸气在高温下反应,生成的H2分子数为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘蔗渣可经化学反应制得酒精 | |
| B. | 棉花、蚕丝和人造丝的主要成分都是纤维素 | |
| C. | 厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解 | |
| D. | 不能用米汤检验食用碘盐中的碘酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.5 mol•L-1 CH3COONa 溶液与 6 mL1 mol•L-1 盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1pH 为 4 的 NaHB 溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | pH 相等的(NH4)2SO4、(NH4)2Fe(SO4)2和 NH4Cl 溶液中:c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2]>c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若8>m>3,则X必定为P区元素 | |
| B. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物一定为极性分子 | |
| C. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y | |
| D. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
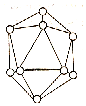 已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图),其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有一个硼原子.通过观察图形及推算,此基本结构单元有12个硼原子构成.把晶体硼的几何图形作一定的规范切削:把每个顶点均匀割掉,可得出化学上与某物质相似的几何外形,新得到的规则几何图形中有20个正六边形,有12个正五边形.
已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图),其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有一个硼原子.通过观察图形及推算,此基本结构单元有12个硼原子构成.把晶体硼的几何图形作一定的规范切削:把每个顶点均匀割掉,可得出化学上与某物质相似的几何外形,新得到的规则几何图形中有20个正六边形,有12个正五边形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的摩尔质量等于其相对分子(原子)质量 | |
| B. | “物质的量”是国际单位制中的一个基本单位 | |
| C. | 1mol任何物质都含有约6.02×1023个原子 | |
| D. | 0.012kgl2C中所含的碳原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com